Soluções de soda cáustica são constantemente utilizadas para ajuste de pH e para neutralizar soluções ácidas. Uma solução de hidróxido de sódio (NaOH) foi preparada dissolvendo-se 200 g de NaOH em 1000 g de água. Determine qual é a concentração em mol/L desta solução. (Dados: densidade da água = 1,0 g/cm3; massas molares: H= 1,0 g/mol, Na= 23 g/mol, O= 16 g/mol; 1 cm3 = 0,001 dm3). Assinale a alternativa CORRETA.
O Sulfato de amônio é um composto inorgânico utilizado na agricultura como
fertilizante. Este sal é obtido pela reação entre a amônia e o ácido sulfúrico, de
acordo com a reação abaixo.
NH3 + H2SO4 → (NH4)2SO4
Se a obtenção deste sal for obtida através da lavagem do gás amônia com uma
solução de ácido sulfúrico, dado que a concentração de amônia é de 34.000 mg/L,
qual seria a concentração de ácido sulfúrico em mol/L necessária para se obter
100% de rendimento? (Dados: massas molares: H= 1,0 g/mol, N= 14 g/mol, O= 16
g/mol, S= 32 g/mol)
Considere a reação a seguir: NaOH + H2SO4 → Na2SO4 + H2O Se para titulação do ácido sulfúrico, foram utilizados 25,0 mL de NaOH com concentração de 0,2 mol.L-1, contra 50,0 mL de ácido, assinale a alternativa CORRETA que corresponde à concentração em mol/L do ácido nessa solução.
Os riscos biológicos em laboratório de análise química estão relacionados com a manipulação de agentes patogênicos, amostras biológicas e/ou contaminadas. De maneira geral, as medidas de segurança para os riscos biológicos envolvem, EXCETO:
Para demonstrar a digestão do amido pela saliva, o professor sugeriu um experimento com dois tubos de ensaio preparados com o seguinte conteúdo: Tubo 1: 2 mL de solução de amido e 2 mL de saliva. Tubo 2: 2 mL de solução de amido. Após 10 minutos, uma gota de iodo diluído foi adicionada a cada tubo. Depois de muita discussão, a turma chegou à conclusão de que o experimento estava incompleto e que, para melhorá-lo, seria necessário: I.substituir o tubo 2 por outro igual, porém com mais 2 mL de água. II.acrescentar um tubo 3, contendo 4 mL de água. III.acrescentar um tubo 4, com 2 mL de saliva mais 2 mL de água. Para resultados mais seguros seria necessário modificar o experimento conforme indicado
O professor de Ciências queria montar um experimento para que
os alunos pudessem entender que a combustão produz gás
carbônico. Para essa finalidade, dispunha de três potes iguais,
que poderiam ser emborcados sobre uma mesma quantidade de
água de cal incolor, conforme a figura a seguir:
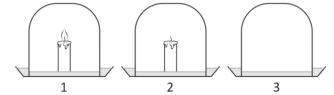
Considerando que os alunos já sabiam que a água de cal incolor
ficava esbranquiçada quando em contato com o gás carbônico
(CO2), o melhor experimento para verificar se a combustão
produz gás carbônico deveria conter
Duas garrafas pet de 500 mL tiveram o fundo retirado e foram
encaixadas, formando um tubo, como mostrado na figura.
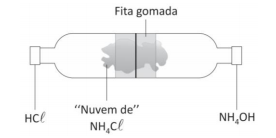
Em uma das tampas foi colocado um algodão embebido em ácido
clorídrico (HCL) e, na outra, um algodão embebido em hidróxido
de amônio (NH4OH). As tampas foram atarraxadas e, em alguns
segundos, os alunos foram surpreendidos com a formação de
uma “nuvem" esbranquiçada, próximo ao centro da montagem.
O professor explicou que a nuvem correspondia a uma espécie de
poeira de cloreto de amônio (NH4CL).
O experimento pode ser utilizado para demonstrar uma reação
de
Leia o fragmento a seguir.
“A Química como ciência tem um campo de sentidos histórico,
cultural e discursivamente construído. Segundo Candela (1995),
os estudos etnográficos que vêm sendo realizados pelos
pesquisadores em Sociologia do Conhecimento Científico têm
considerado que, para os cientistas, a ciência realiza-se nas
práticas discursivas cotidianas e é uma reflexão e um debate
sobre alternativas explicativas.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento.
Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Entendendo a ciência como discurso, segundo Machado, é
possível considerar que
I. a ciência é uma construção social que envolve versões
diferentes sobre os temas abordados.
II. a linguagem científica pode possibilitar aos sujeitos uma
maneira de pensar/falar sobre o mundo.
III. a linguagem científica possui características próprias como
forma de registrar e ampliar o conhecimento científico.
Está correto o que se afirma em
No estudo de Termoquímica, o professor propôs uma experiência
para determinação do calor de combustão do álcool etílico
(etanol).
O procedimento experimental e as anotações de um grupo de
alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente
de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e
anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no
caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma
proveta e transferir para o erlenmeyer. Envolver as paredes
do erlenmeyer com jornal e prender com fita crepe. Colocar
em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor.
Valor anotado Ti = 25°C;
VI. acender a lamparina e aquecer a água do erlenmeyer,
durante 5 minutos. Após esse tempo, apagar a lamparina e
medir a temperatura da água (Tf) e anotar o valor. Valor
anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema
“álcool-lamparina”(mf) após a combustão. Valor anotado
mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1.°C–1 como
calor específico da água e a constante 0,2 cal.g–1.°C–1 como calor
específico do vidro, os alunos devem chegar a um valor para o
calor de combustão do álcool, em cal.g–1, de
Leia o fragmento a seguir.
“De acordo com a perspectiva _____, a aula de química é um
espaço de _____ do pensamento químico e de (re)elaboração de
_____.”
Assinale a opção que completa corretamente as lacunas do
fragmento acima.
Com relação às estratégias de ação propostas nos Parâmetros
Curriculares Nacionais para as aulas de Química no Ensino Médio,
analise as afirmativas a seguir.
I. A seleção e a organização de temas, conteúdos e habilidades,
parte essencial dos processos de ensino e aprendizagem, são
suficientes para alcançar as metas almejadas de formação e
desenvolvimento de competências.
II. As atividades experimentais merecem especial atenção e tem
como finalidade específica confirmar as ideias apresentadas
anteriormente pelo professor.
III. O uso do computador no ensino é particularmente
importante nos dias de hoje, mas a confiabilidade das fontes
de informações deve ser objeto de atenção do professor.
Assinale:
Um dos critérios que pode ser utilizado para classificar águas
naturais é o de dureza, propriedade que resulta da dissolução de
minerais do solo e das rochas ou do aporte de resíduos
industriais.
A classificação de águas naturais, de acordo com a dureza, é
expressa em função da concentração de
As substâncias húmicas presentes nos solos, nos sedimentos e
nas águas naturais são formas importantes de distribuição da
matéria orgânica na Terra.
O controle das propriedades físicas e químicas dos vários
ambientes naturais está relacionado à presença dessas
substâncias.
Assinale a opção que apresenta propriedades das substâncias
húmicas.
Dois recipientes idênticos chamados 1 e 2, contém respectivamente, 64 g de SO2 (M = 64g/mol) à pressão P1 e temperatura de 27 ºC e 64 g de O2 (M = 32g/mol) à pressão P2 e temperatura 327 ºC. Comparando-se as pressões dos gases, tem-se:
A análise quantitativa por espectrofotometria UV/Visível
é muito utilizada para doseamento de determinados
princípios ativos e corantes em formulações
farmacêuticas disponíveis no mercado. Essa análise é
confiável desde que obedeça a Lei de Beer, ou seja, a
solução analisada deve obrigatoriamente seguir uma
relação linear entre a absorbância e a concentração.
Considere a análise de um determinado fármaco
que obedece a Lei de Beer. O que aconteceria com o
valor de Absorbância se a concentração da solução
do fármaco fosse o dobro? Considere que para esta
análise utilizou-se uma cubeta de 1,00 cm de caminho
óptico. O que aconteceria com o valor de Absorbância
se uma nova medida fosse realizada com uma cubeta
de 5,00 cm de caminho óptico?

