Qual a massa de glicose (C6H12O6) que se deve
utilizar para preparar 250 mL de uma solução
aquosa 1,5 M desse açúcar?
Considere: massa atômica do carbono = 12,0 Da;
massa atômica do hidrogênio = 1,0 Da e massa atômica
do oxigênio =16,0 Da
Assinale a alternativa CORRETA:
Plasmídeos são DNAs extracromossomais de
replicação autônoma, extensamente utilizados como
vetores moleculares em engenharia genética. Um
dos métodos utilizados para a extração desse tipo de
macromolécula de bactérias é chamado de lise
alcalina ou minipreparação (Miniprep) e é composto
de várias etapas nas quais as seguintes
substâncias/soluções são utilizadas:
Solução I: Tris-HCl (pH 7.5) 100 mM; EDTA 10mM;
Solução II: NaOH 1 M; SDS 5.3% (p/v). Após adição
de 130 mL de água destilada a solução
fica NaOH 0.2 M e SDS 1% (p/v)
Solução III: Acetato de potássio 3 M; ácido acético 2 M
Tampão TE: Tris-HCl (pH 7.5) 10 mM; EDTA 0.1 mM
Isopropanol: 100%
Etanol: 70%
No que se refere às funções das soluções
anteriormente citadas, assinale a alternativa
INCORRETA:
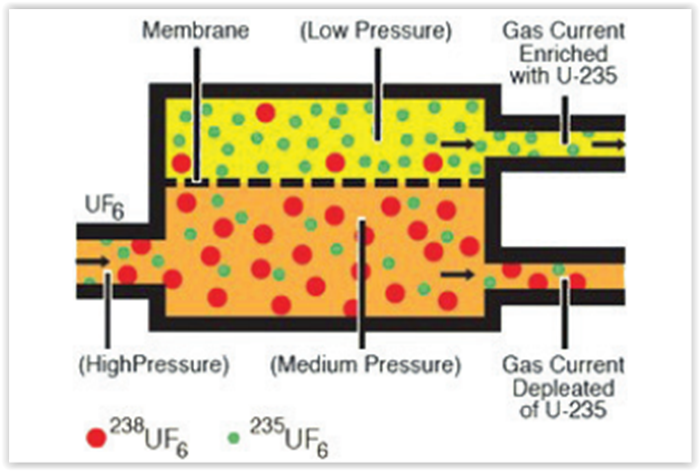
Uma das etapas de enriquecimento do urânio consiste
na separação do hexafluoreto de urânio, contendo U-235
do U-238, analise o esquema representado a seguir:
I.Ocorre redução da pressão do sistema naturalmente,
pois na linha de entrada da mistura de gases, ocorre
uma expansão na chegada a câmara de difusão em
membrana.
II.A introdução de um sistema de vácuo na linha do U -235
enriquecido favorece a maior velocidade da separação
dos componentes do sistema.
III.A difusão do composto contendo U-238 pela membrana
é mais intensa, por isso é necessário reduzir a pressão
do sistema garantindo assim a maior passagem pela
membrana do composto contendo U – 235.
São verdadeiras as afirmações contidas na alternativa:
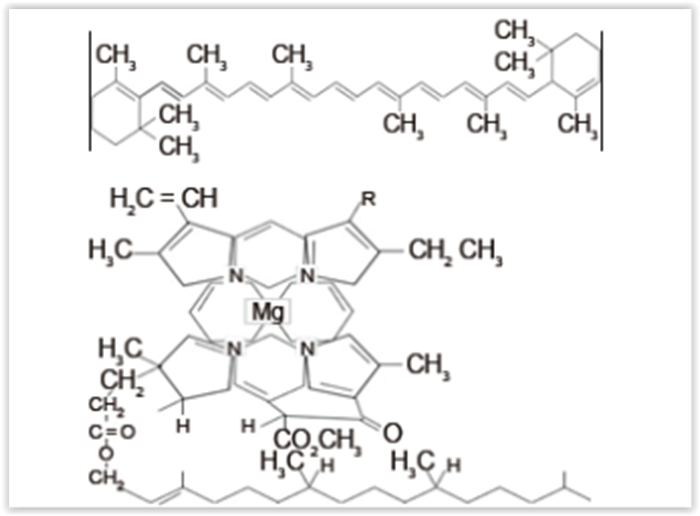
O espinafre é uma planta de interesse nutricional
constituída principalmente de dois grupos de
moléculas os carotenóides e as clorofilas. A técnica da
cromatografia em coluna é importante no processo de
isolamento dessas substâncias. Após uma preparação
conveniente, o extrato do espinafre é adicionado
à coluna cromatográfica, onde uma das moléculas
têm mais afinidade ao sulfato de cálcio (CaSO4) que
constitui a coluna. É adicionado hexano que arrasta a
primeira banda. Ao se mudar a fase móvel para acetona,
retira-se as moléculas que mais interagiram com a fase
estacionária, formando a segunda banda. Abaixo se
encontram as fórmulas estruturais das duas moléculas
principais que constituem o extrato de espinafre e que
podem ser retiradas pelo procedimento descrito:
Com base nos seus conhecimentos sobre LC, no texto
e nas estruturas das moléculas assinale o que está
correto:
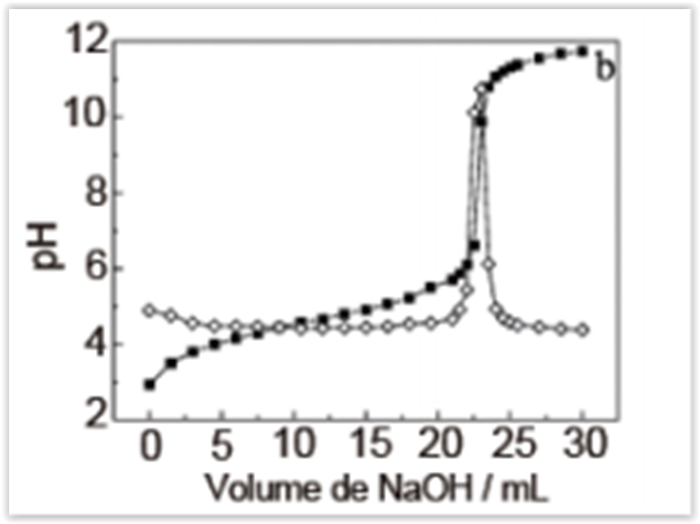
A figura a seguir apresenta duas curvas quase
que sobrepostas, correspondentes ao mesmo
procedimento: a curva de titulação entre um fármaco
ácido e NaOH e a curva obtida quando se tira a 1ª
derivada da curva de titulação. Analise as afirmações e
escreva V para verdadeiro ou F para falso:
( ) A titulação envolve ácido fraco e base forte, se não fosse potenciométrica a utilização de fenolftaleína como indicador, teria
preferência a utilização de alaranjado de metila.
( ) O p.e. (ponto de equivalência) será em pH igual 7.
( ) o pKa do titulado é próximo a 5.
( ) A derivada da curva tem por finalidade indicar o volume
gasto até o p.e. para a neutralização.
( ) O sitema atua como um tampão na faixa 4
Um estudante pretende preparar uma solução 2,0 mol L-1 a partir do ácido clorídrico concentrado. Ao abrir um manual elaborado por estudantes do Ensino Médio se deparou com as seguintes afirmações: I.“Realizem o procedimento na bancada do laboratório, utilizando avental, óculos de segurança e luvas.” II.“Retirem uma alíquota do ácido clorídrico concentrado vertendo-a em um béquer, pipetem o volume necessário a partir do béquer e transfira o volume para o balão volumétrico e adicionem água até o menisco e agitem.” III.“Despejem cuidadosamente o volume pipetado de ácido clorídrico concentrado na água.” IV.“Evite o contato dos vapores do ácido clorídrico com olhos e mucosas, lavando a mão com água ao término do procedimento.” É correto apenas o que se afirma em:
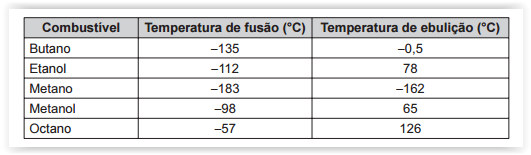
o quadro apresenta alguns exemplos de combustíveis empregados em residências, indústrias e meios de transporte.
São combustíveis líquidos à temperatura ambiente de 25°C:
Os elementos aparecem na tabela periódica representados por um símbolo acompanhado do número atômico e número de massa respectivos. Assinale a alternativa em que o nome do elemento químico NÃO corresponde com o símbolo
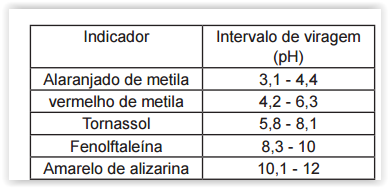
Deseja-se titular 50 mL de uma solução
aquosa de amoníaco (0,3 mol L-1), NH3 ( Kb = 1,8x 10-5), com HCl 0,3 mol L-1. Para isso, com base
nas informações da lista abaixo, qual indicador
deve ser usado para para essa titulação?
320mL de uma solução aquosa saturada de CaC2O4 necessita de 8,1mL de uma solução aquosa de KMnO4 a 0,0011 mol L-1 para completa oxidação do íon C2O4-2 em meio ácido. Com base nessa informação, é possível concluir que o Kps do CaC2O4 é:
Uma mistura sólida de massa igual a
1,1000g é composta por dois sais com fórmulas
genéricas, AX e BX, sendo os sais compostos
por cátions monovalentes e o mesmo ânion X-,
monovalente. O primeiro sal possui massa molar
60g/mol e o segundo possui massa molar 80g/
mol. A mistura é dissolvida em água isenta do
ânion X- e a seguir tratada com uma solução
de um nitrato de um metal M, em excesso.
Esse metal forma com o ânion X- um composto
insolúvel MX de massa molar igual a 120g/
mol. Após filtragem e secagem dos cristais de
MX, estes foram pesados em balança analítica
obtendo-se o valor de 1,8000g. Assinale a opção
que mostra as porcentagens em massa de cada
um dos sais na mistura sólida inicial.
“Em tratamento de efluentes, esse processo é utilizado
para remoção de óleos, gorduras e sólidos suspensos e na
separação e concentração de lamas. Nesse processo, as
impurezas são retiradas pela parte superior e, na parte
inferior, permanece o efluente tratado. Isso pode ocorrer
por diferença de densidade”.
A descrição acima refere-se a que processo?
A Resolução Normativa nº 36/74 do Conselho Federal de Química dá atribuições aos profissionais da Química e estabelece critérios para concessão das mesmas. Assinale a alternativa que contém uma atividade que não está prevista nas atribuições do Técnico Químico (Técnico de Grau Médio), de acordo com a resolução.
Assinale a alternativa que contenha um exemplo de fórmula molecular de um ácido classificado como Oxiácido.
Um fiscal, ao realizar a separação de uma mistura, optou por um processo físico que serve para separar misturas homogêneas, ou soluções de sólidos em líquidos ou soluções de dois ou mais líquidos. Assinale a alternativa que contém o nome do processo de separação de misturas utilizado pelo fiscal.