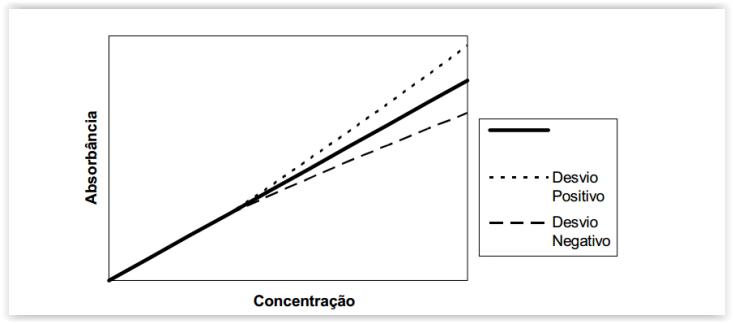
Os desvios por limitação da Lei de Lambert-Beer são aqueles que as interações
do analito com o solvente e demais solutos variam com o aumento da
concentração. Observe o gráfico abaixo e assinale quais afirmativas são
VERDADEIRAS.
I. Em soluções concentradas do analito ou outros solutos, as interações soluto-soluto
alteram a estrutura do analito e também modificam a sua absortividade.
II. Ao ocorrer um desvio na Lei de Lambert-Beer ainda pode-se trabalhar com a curva de
calibração, embora ela não seja uma reta.
III. Como os desvios normalmente ocorrem em concentrações muito baixas, uma das
soluções mais comuns é a pré-concentração.
IV. Os desvios são positivos e negativos conforme as alterações aumentem ou diminuam
a absorvidade.
V. Os desvios podem ser químicos ou causados pela instrumentação, entretanto, neste
último, o desvio é praticamente nulo, devido a equipamentos de alta tecnologia.
A lista abaixo descreve aleatoriamente as
etapas realizadas na preparação de uma solução
aquosa de HCl
A - Completa-se com água destilada até o traço
de referência do balão (menisco), com auxílio de
uma pipeta de Pasteur.
B - Adiciona-se o volume de HCl (calculado
previamente) com auxílio da pipeta graduada e
pêra de sucção, em capela de exaustão.
C - Identifica-se com nome do ácido, concentração,
data de preparo e responsável pela preparação.
D - Coloca-se em um balão volumétrico uma
alíquota de água destilada.
E - Transfere-se a solução preparada com auxílio
de um funil a um recipiente de vidro âmbar.
F - Tampa-se o balão, agita-se e inverte-se
por pelo menos 10 vezes para homogenizar o
sistema.
Com base nessas informações, assinale a
alternativa que apresenta a ordem CORRETA
das etapas no preparo dessa solução.
Em um processo químico, certas substâncias sofrem transformações em relação ao seu estado inicial (reagentes), dando origem ao aparecimento de novas substâncias (produtos), diferentes dos reagentes. Quando as substâncias reagem, às vezes, ocorrem fatos bastante visíveis que confirmam a ocorrência da reação e, dentre eles, podemos destacar: desprendimento de gás, emissão de luz, mudança de coloração e cheiro, formação de precipitados etc. Um exemplo de reação química muito comum em nosso cotidiano é a reação de combustão. Com base nisso, podemos afirmar que a alternativa que caracteriza um processo químico é:
Alguns elementos fogem à regra do octeto, ou seja, estabilizam-se sem que apresentem oito elétrons no último nível. São exemplos de substâncias que apresentam elementos com essas carcaterísticas:
“Consistem em partículas com diferentes tamanhos, formas
e composição química, as quais foram transportadas pela
água, ar ou gelo do ambiente terrestre de origem e
depositadas no fundo de lagos, rios e oceanos”.
O texto trata do conceito de:
“Quando alguma condição que determina o equilíbrio é
modificada, o sistema responde, no sentido de amenizar a
perturbação sofrida”.
O texto corresponde ao(à):
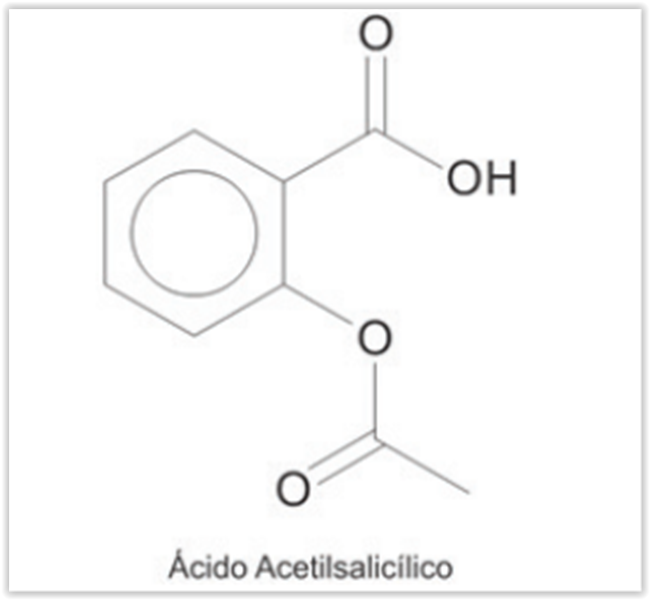
Na análise volumétrica de 0,5 g de uma amostra de
medicamento constituído por ácido acetilsalicílico
(AAS), foram utilizados 15 mL de hidróxido de sódio com
concentração 0,01mol/L Considerando que a reação
com a base ocorre apenas para o ácido acetilsalicílico,
não tendo participação das outras substâncias reativas
na amostra, qual a porcentagem de AAS presente no
fármaco analisado? Dados: M (AAS) = 180,16g/mol
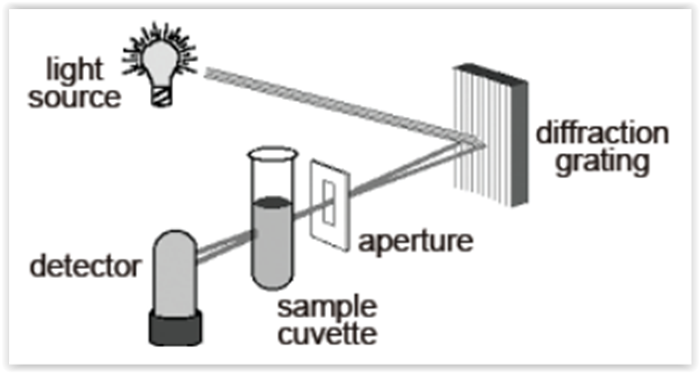
A figura a seguir apresenta um esquema simplificado
de um equipamento de espectrofotometria de absorção
molecular, analise as propostas apresentadas:
I.A rede de difração seleciona o comprimento de onda
para se proceder na investigação, porém a seletividade
do sistema está relacionada com a abertura da fenda
de passagem de luz, quanto menor a fenda, mais
específico será o comprimento de onda selecionado.
II.Absorbância está relacionada com a intensidade de luz
visível que a amostra absorveu, sendo que se a cubeta
apresentar maior ou menor caminho óptico o sinal de
absorbância permanece o mesmo, já que a solução não
foi alterada.
III.Soluções muito concentradas podem causar um
bloqueio da luz incidente ao passar pela cubeta, fora
da proporcionalidade, com isso ocorre um desvio
de linearidade, além disso, este sistema também é
prejudicado por material particulado ou manchas na
superfície da cubeta.
São verdadeiras:
No laboratório de controle da qualidade da água e tratamento do esgoto da CASAN, o técnico deve realizar a análise de amostras de esgoto para verificação de sólidos totais e voláteis a altas temperaturas. Para essa verificação, ele utilizará qual equipamento?
Um técnico de laboratório da CASAN irá coletar amostras que não podem sofrer aeração, pois serão
destinadas aos ensaios de oxigênio dissolvido e sulfetos. Essas amostras devem ser coletadas na
superfície da água. Para essa coleta, ele utilizará o seguinte equipamento, que é denominado
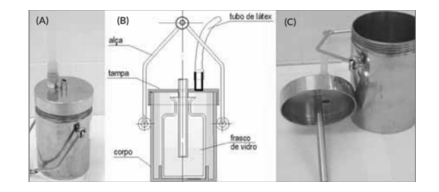
Em uma aula de Ciências, um aluno fez o seguinte questionamento: Todos falam que o ar expirado tem mais gás carbônico que o inspirado, mas como podemos ter certeza? O professor explicou que, agitando água de cal incolor no ar contido no interior de sacos plásticos, é possível demonstrar a presença de gás carbônico. Considerando a utilização de sacos plásticos do mesmo tamanho, com 5 mL de água de cal incolor, assinale a opção que indica o melhor experimento capaz de permitir que os alunos verificassem se o ar expirado contém mais ou menos gás carbônico que o inspirado.
No estudo dos modelos atômicos, a hipótese atômica de John
Dalton (1766-1844) é trazida para sala de aula dando base à
discussão sobre a constituição da matéria.
Para o desenvolvimento do trabalho sobre o modelo de Dalton é
importante a discussão sobre
Leia o fragmento a seguir.
“Os conteúdos químicos de natureza simbólica estão agrupados
no nível representacional, que compreende informações inerentes
à linguagem química, como fórmulas e equações químicas. O
aspecto representacional inclui ferramentas simbólicas para
representar a compreensão dos processos de idas e vindas entre
teoria e experimento. (...) Nas análises do momento discursivo
que denominei Elaborando uma Forma Química de Pensar, a
questão dessa dimensão constitutiva da linguagem química
adquire visibilidade.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Sobre as concepções estabelecidas pela autora sobre o momento
discursivo, analise as afirmativas a seguir.
I. Para entender as equações químicas os alunos devem
aprender uma série de conceitos.
II. A equação química e a linguagem química são instrumentos
para a elaboração do pensamento químico.
III. A partir da linguagem química, no movimento de significação
das representações vai se constituindo certa forma de
pensamento.
Assinale:
Sobre a poluição dos recursos hídricos, o excesso de matéria orgânica aportada nos sedimentos do rio provoca a morte de peixes, devido à(ao)
Leia o fragmento a seguir.
“Os alquimistas do século XIV tornaram-se os primeiros a
compreender a natureza dos ácidos. O único ácido conhecido
pelos antigos fora o ácido acético fraco do vinagre. No século VIII,
Djabir havia preparado uma solução fraca de ácido nítrico e
outros alquimistas árabes descobriram que a destilação do
vinagre produzia um ácido acético mais forte. Mesmo o ácido
acético forte, porém, pouco tinha de corrosivo. Não parecia ser
dotado de muito poder reagente.”
(STRATHERN, P. O sonho de Mendeleiev.
A verdadeira história da química. 2002, Zahar, p. 57).
Com relação aos ácidos, assinale V para a afirmativa verdadeira e
F para a falsa.
( ) O ácido acético pode ser classificado como forte ou fraco
dependendo do valor do seu Ka, o que explica as observações
obtidas pelos alquimistas.
( ) O ácido nítrico é um ácido fraco, o que corresponde ao
observado experimentalmente pelos alquimistas.
( ) Tanto o ácido acético como o ácido nítrico são ácidos fortes,
porém os alquimistas não tinham informações suficientes
para classificá-los corretamente.
As afirmativas são, respectivamente,