O nitrogênio amoniacal é um parâmetro relevante para avaliação
da qualidade da água e pode ser determinado pelo método de
Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de
um efluente foi adequadamente transformado em amônia que
foi recolhida em solução de ácido bórico. Posteriormente o
borato formado foi titulado, consumindo 24 mL de solução
padrão de ácido sulfúrico 0,5 mol.L-1.
A massa de nitrogênio (em mg) presente na amostra, é
aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N =14
A Pedra de Itapuca é um monumento natural
localizado entre as praias de Icaraí e das Flechas, sob
a designação indígena de Itapuca (pedra furada) por
haver tido, em sua forma original, um túnel natural. A
pedra, que foi parcialmente demolida para dar
prosseguimento ao Plano de Arruamento de
1840-1841 (
http://culturaniteroi.com.br/blog/?id=505), abriga a
lenda da índia Jurema e do guerreiro Cauby. Foi
tombada em 1985 pelo Instituto Estadual do
Patrimônio Cultural.

Esta formação rochosa é de gnaisse, um tipo de
rocha:
O gás natural é composto, em sua maior parte, por
Considerando que o íon alumínio é trivalente (A f3) e o
íon sulfato é divalente (S 0 4 2), assinale a alternativa
que apresenta a fórmula química do sulfato de
alumínio.
Sobre soluções e propriedades coligativas julgue as afirmativas a seguir.
I.Ponto de orvalho é o nome dado ao ponto de saturação do vapor de água no ar atmosférico.
II.Uma solução de cloreto de sódio em água congela acima da temperatura de congelamento da água pura.
III.É possível separar soluto e solvente de uma solução verdadeira por meio de filtração simples.
IV.Existe liga metálica que é exemplo de uma solução sólida.
V.O aumento da temperatura promove o aumento da solubilidade de gases em líquidos.
Está correto o que se afirma apenas em:
Qualquer laboratório, principalmente de Química,
pode se tornar em um local muito perigoso, quando
se usa inadequadamente materiais e equipamentos.
Nesse contexto, é importante o conhecimento de
boas práticas de laboratório. Com relação a essas
práticas, identifique se são
verdadeiras (V ) ou falsas (F ) as seguintes afirmativas:
( ) No encerramento do expediente, não se deve
deixar equipamentos elétricos ligados nas
tomadas, sob hipótese alguma.
( ) Para exercer as atividades de laboratório é
obrigatório o uso de guarda-pó, sapatos
fechados e cabelos presos.
( ) Na bancada ou nos bancos, quando for o caso,
pode-se colocar livros, sacolas, ferramentas
etc.
( ) É proibido fumar no laboratório. Somente será
permitido fumar na capela, onde a saúde dos
usuários não será exposta a risco.
( ) Deve-se sempre manter os acessos
desimpedidos,e o interior do laboratório limpo e
organizado.
Assinale a alternativa que apresenta a sequência
CORRETA, de cima para baixo:
Na rotina de um laboratório de Química, a geração de resíduos sólidos e líquidos tóxicos é inevitável. Consequentemente, procedimentos e cuidados devem ser adotados para os rejeitos ou tratamentos desses resíduos. Com base no assunto, considere a afirmação CORRETA:
Os indicadores são substâncias naturais ou sintéticas
que apresentam cores bem distintas em ácido e
básico. Para uma série de indicadores, as seguintes
cores e faixa de pH sobre a qual a mudança de cor
ocorre são apresentadas na tabela abaixo:
Assinale a alternativa que apresenta a afirmação
CORRETA:
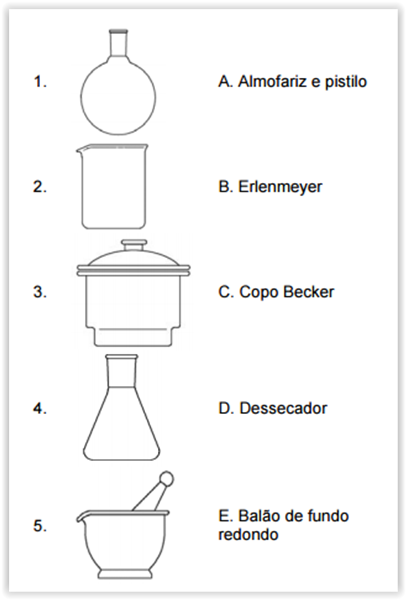
A seguir, são mostradas ilustrações (coluna à
esquerda) e os nomes (coluna à direita) de algumas
vidrarias de laboratório:
Assinale a alternativa que correlaciona,
corretamente, as colunas.
Os gráficos seguintes mostram a variação do pH de
20 cm³ de solução alcalina de 1 mol L–1 quando a
solução de ácido 1 mol L–1 é adicionada. Qual dos
gráficos mostrados abaixo corresponde a uma
titulação de amônia aquosa com ácido nítrico?
Quantos gramas de cloreto de sódio (NaCl) você usaria para fazer 10 L de uma solução 0,01 M?
(Considere as seguintes massas atômicas em Daltons: sódio 23, cloro 35,5).
A figura a seguir esquematiza de forma detalhada
parte dos componentes eletrônicos de um RMN
necessários para se obter e processar o sinal de FID
(Free Iduction Decay):

RF = radiofrequencies, AF = audiofrequencies, ADC =
Analogue-to-digital converter, DSP = Digital Signal
Processor, HC = Host Computer.
A partir desse esquema, foram feitas as seguintes
afirmativas:
I. O sinal FID é induzido a partir de um sinal de
rádio-frequência.
II. A função do “Bandpassfilter" é subtrair o sinal
observado do sinal de referência, reduzindo a
frequência observada (em MHz) para a faixa
audível (em kHz).
III. A função do ADC é tornar o sinal mensurável.
IV. A função do DSP é transformar o sinal analógico
em um espectro.
Assinale a alternativa correta:
Analise as seguintes alternativas e assinale a CORRETA:
Baseado no modelo vetorial, após um pulso de 90º na direção do detector, inicia-se o FID (Free Iduction Decay). Analise as seguintes alternativas e assinale a CORRETA:
O espectro de RMN de 13C e de DEPT (em CDCl3) de uma molécula orgânica evidencia os sinais em δ 166,4 (S ), 144,2 ( D); 122,7 (D ); 59,9 (T ), 17,8 (Q ) e 14,1 (Q ), enquanto o espectro de RMN 1 H dessa mesma molécula, em CDCl3, evidenciou cinco sinais integrando na proporção de 1:1:2:3:3 (de maior para menor frequência). Sendo em δ 6,97 (dq, J = 15,3 e 7,1 Hz), δ 5,85 (d, J = 15,3 Hz), δ 4,25 (q ), δ 1,87 (dd, J= 7,1 e 1,7 Hz) e δ 1,30 (t ). A partir dessas informações, assinale a alternativa CORRETA: