Uma mistura sólida de massa igual a
1,1000g é composta por dois sais com fórmulas
genéricas, AX e BX, sendo os sais compostos
por cátions monovalentes e o mesmo ânion X-,
monovalente. O primeiro sal possui massa molar
60g/mol e o segundo possui massa molar 80g/
mol. A mistura é dissolvida em água isenta do
ânion X- e a seguir tratada com uma solução
de um nitrato de um metal M, em excesso.
Esse metal forma com o ânion X- um composto
insolúvel MX de massa molar igual a 120g/
mol. Após filtragem e secagem dos cristais de
MX, estes foram pesados em balança analítica
obtendo-se o valor de 1,8000g. Assinale a opção
que mostra as porcentagens em massa de cada
um dos sais na mistura sólida inicial.
O Sulfato de amônio é um composto inorgânico utilizado na agricultura como
fertilizante. Este sal é obtido pela reação entre a amônia e o ácido sulfúrico, de
acordo com a reação abaixo.
NH3 + H2SO4 → (NH4)2SO4
Se a obtenção deste sal for obtida através da lavagem do gás amônia com uma
solução de ácido sulfúrico, dado que a concentração de amônia é de 34.000 mg/L,
qual seria a concentração de ácido sulfúrico em mol/L necessária para se obter
100% de rendimento? (Dados: massas molares: H= 1,0 g/mol, N= 14 g/mol, O= 16
g/mol, S= 32 g/mol)
Ao realizar uma inspeção em um depósito de materiais reciclados, um fiscal encontrou uma estátua fabricada em cobre puro, cuja massa é de 612g. Sabendo-se que a massa molar do cobre é de 63,55 g.mol-1, quantos mols de cobre contém a estátua?
A grafite, também chamada chumbo negro ou plumbagina, tem múltiplas e importantes aplicações industriais, embora seja mais conhecida popularmente por sua utilização como mina do lápis. Quantos átomos de carbono são encontrados em uma massa de 1,02g de grafite? (Dado: número de Avogadro = 6,02x1023)
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
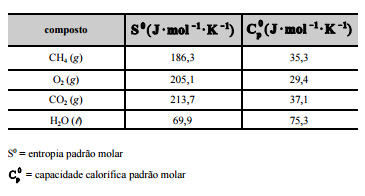
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.
Devido à sua reatividade, o fósforo não é encontrado na forma
elementar na natureza, porém forma parte de numerosos
minerais. A forma alotrópica branca pode ser obtida a partir do
aquecimento do fosfato de cálcio em um forno a 1450°C em
presença de sílica e carbono. O fosfato é reduzido a fósforo, que
se libera na forma de vapor.
2Ca3(PO4)2 + 6 SiO2 +10 C → 6CaSiO3 + 10 CO + P4
O fósforo branco obtido é, então, condensado em água, evitando-
se a presença de ar para que não inflame. O fósforo branco é
extremamente venenoso - uma dose de 52mg pode ser fatal.
A massa de Ca3(PO4)2 que deverá reagir para produção da dose
letal citada no texto é de :
Dados: Massa molar O = 16g.mol–1 P = 31g.mol–1 Ca = 40g.mol–1
Um método clássico da química analítica de medir o teor de água oxigenada é a reação da água oxigenada com íon permanganato, que é reduzido a Mn+2, em meio ácido, de acordo com a equação a seguir (não balanceada).
KMnO4(aq) + H2O2(aq) + H+ (aq) → Mn2+ (aq) + H2O(l) + O2(g)
Um analista recebeu em um Erlenmeyer um volume de 10 mL de uma amostra de água oxigenada e acrescentou 100 mL de água destilada. A análise foi feita utilizando 15,3 mL de uma solução padrão de permanganato de potássio padrão 0,1103 mol/L. (Considere as seguintes massas moleculares (g/mol): Mn = 55; H = 1; O = 16; K = 39.)
O teor de H2O2 na amostra anterior, expresso em g% (m/V), e o de mol/L são, respectivamente,
O dióxido de enxofre é um gás utilizado na produção do ácido
sulfúrico. Esse gás é emitido na queima de combustíveis e pode
ser muito prejudicial à saúde e ao meio ambiente. Para analisar a
presença de dióxido de enxofre em um determinado local, uma
amostra de ar foi borbulhada em 500 mL de um meio que
promoveu a conversão total do dióxido de enxofre em sulfato.
A amostra resultante foi analisada em um cromatógrafo iônico
em condições apropriadas, na mesma temperatura,
demonstrando que a concentração de sulfato presente
corresponde a 1 mmol . L–1.
A massa (em mg) de dióxido de enxofre presente na amostra é:
Dados: Massa molares (g.mol–1) S = 32 e O = 16
O Bi3+ pode ser determinado através da formação de BiOI
(oxiiodeto), neste método a solução fria contendo nitrato de
bismuto (III) deve ser levemente acidulada com ácido nítrico e em
seguida deve ser feita lentamente e com agitação, a adição de
iodeto de potássio na forma de pó para que ocorra formação do
BiI3 (triiodeto de bismuto) que em seguida é fervido com água
quente. Neste procedimento é formado um precipitado de BiOI
cor de cobre que deve ser filtrado, lavado com água e secado a
cerca de 110o
C até peso constante e em seguida pesado.
Utilizando o método descrito em condições apropriadas, a
quantidade de Bi3+ em uma amostra contendo nitrato de bismuto
(III) foi determinada através da formação de um precipitado de
BiOI, que após lavagem e secagem pesou 0,1g. Nestas condições,
a massa (em miligramas) de Bi3+ presente na amostra é,
aproximadamente:
Dados: Massa molares (g.mol–1) Bi = 209; Bi(NO3)3 = 395 e BiOI = 352
Os filmes finos são usados em microeletrônica como condutores,
resistores, capacitores e em revestimentos óticos em lentes.
Esses filmes podem ser produzidos pela deposição de vapor
químico, utilizando tetrabrometo de titânio que é evaporado e
misturado com hidrogênio gasoso. A mistura é passada sobre
uma superfície aquecida a aproximadamente 1300ºC. O haleto
metálico sofre reação com hidrogênio para formar um
revestimento de titânio metálico.
A massa máxima de titânio metálico que poderá ser produzida
quando 8 mol de gás hidrogênio reagem com o tetrabrometo de
titânio, considerando um rendimento de 100% no processo, é:
Dados: Massa molar (g.mol–1): H = 1Ti = 48 Br=80
Os compostos de enxofre, sobretudo o dióxido de enxofre, SO2, esteio entre os gases poluentes mais comuns. Vários métodos tem sido
desenvolvidos para a remoção de SO2 dos gases formados quando o carvão o petróleo seio queimados. o calcário em pó pode ser injetado no forno de uma usina de energia, onde se decompõe em Ca0 e CO2, sendo o processo de remoção de SO2 ilustrado no esquema a seguir:
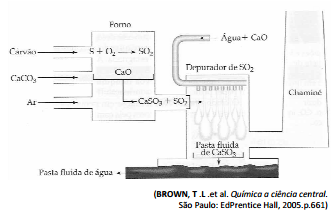
Considerando que com esse processo é possível retirar todo o SO2 produzido na queima
do carvão, o numero de moléculas desse gás que deixariam de atingir a atmosfera, reagindo totalmente 28kg de CaO, é
Dados: Massa molar (g.mor1): 0 = 16Ca = 40
A palavra mol, introduzida na química por Wilhem Ostwald em 1896, vem do latim mole, que significa “monte" ou “quantidade". Mas, afinal, quanto vale esse número N que utiliza-se para chegar ao conceito de mol? Hoje sabe-se que seu valor é, aproximadamente, 6,02 X 10 entidades/mol. Esse valor é conhecido como constante de:
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 molL1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 mol1
O rótulo de um frasco de efluente aquoso indica 100 ppm de íons chumbo(II). Sabendo-se que a densidade do efluente é 1,0 g/mL, a concentração de íons chumbo(II) no efluente, em mol/L, é igual a: