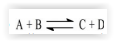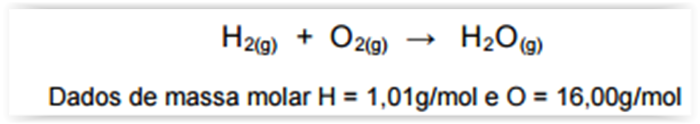Em uma aula prática, 10 adições de 0,02 mL de uma solução 0,37 mol l-1 de sacarose são feitas em um balão volumétrico de 5 mL contendo 1 mL de água destilada. Após essas adições, a concentração de sacarose no balão, em mol l-1, será de:
Visando determinar o teor de umidade de uma amostra de solo contaminado, um perito recolheu 4,860g de amostra previamente homogeneizada para uma cápsula de porcelana de massa igual a 22,148g. Após 6 horas de secagem em estufa a 110°C, seguida de resfriamento em dessecador até temperatura ambiente, a cápsula contendo a amostra de solo apresentou massa igual a 25,451g. Assinale a alternativa que contém a porcentagem de umidade na amostra de solo analisada.
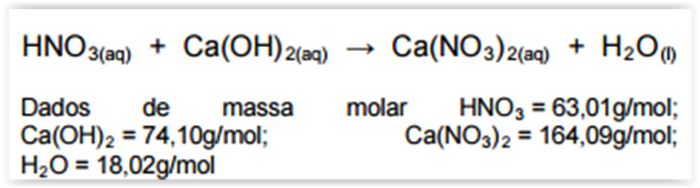
Considerando-se a reação de neutralização total não
balanceada a seguir, assinalar a alternativa CORRETA:
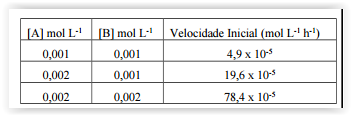
A equação
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são
também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram col°Cadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
Um analista precisa preparar uma solução aquosa de 1000 mg l-1 de Th(NO3)4. No almoxarifado, ele tem à sua disposição um frasco contendo Th(NO3)4.5H2O, com indicação de 80% de pureza. Qual é a massa de sal, em gramas, necessária para preparar 1 litro da solução Th(NO3)4?
A análise elementar de um composto orgânico resultou em 48,63% de carbono, 43,19% de oxigênio e 8,18% de H. Sabendo-se que o peso molecular desse composto é 222,3 g mol-1, sua fórmula molecular é:
O metano é um dos subprodutos dos aterros sanitários, produzido pela decomposição anaeróbica de resíduos orgânicos. Os produtos de sua combustão são C02 e H2O. Quantos mols de vapor de água podem ser produzidos por 4,0 g de metano?
Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:Considere que a massa do próton é igual à massa do nêutron e vale 1,7 x 10-27 kg.
A reação a seguir é usada para produzir eletricidade
em uma célula a combustível. Com relação à reação,
assinalar a alternativa CORRETA:
Uma mistura sólida de massa igual a
1,1000g é composta por dois sais com fórmulas
genéricas, AX e BX, sendo os sais compostos
por cátions monovalentes e o mesmo ânion X-,
monovalente. O primeiro sal possui massa molar
60g/mol e o segundo possui massa molar 80g/
mol. A mistura é dissolvida em água isenta do
ânion X- e a seguir tratada com uma solução
de um nitrato de um metal M, em excesso.
Esse metal forma com o ânion X- um composto
insolúvel MX de massa molar igual a 120g/
mol. Após filtragem e secagem dos cristais de
MX, estes foram pesados em balança analítica
obtendo-se o valor de 1,8000g. Assinale a opção
que mostra as porcentagens em massa de cada
um dos sais na mistura sólida inicial.
O Sulfato de amônio é um composto inorgânico utilizado na agricultura como
fertilizante. Este sal é obtido pela reação entre a amônia e o ácido sulfúrico, de
acordo com a reação abaixo.
NH3 + H2SO4 → (NH4)2SO4
Se a obtenção deste sal for obtida através da lavagem do gás amônia com uma
solução de ácido sulfúrico, dado que a concentração de amônia é de 34.000 mg/L,
qual seria a concentração de ácido sulfúrico em mol/L necessária para se obter
100% de rendimento? (Dados: massas molares: H= 1,0 g/mol, N= 14 g/mol, O= 16
g/mol, S= 32 g/mol)
Ao realizar uma inspeção em um depósito de materiais reciclados, um fiscal encontrou uma estátua fabricada em cobre puro, cuja massa é de 612g. Sabendo-se que a massa molar do cobre é de 63,55 g.mol-1, quantos mols de cobre contém a estátua?
A grafite, também chamada chumbo negro ou plumbagina, tem múltiplas e importantes aplicações industriais, embora seja mais conhecida popularmente por sua utilização como mina do lápis. Quantos átomos de carbono são encontrados em uma massa de 1,02g de grafite? (Dado: número de Avogadro = 6,02x1023)
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
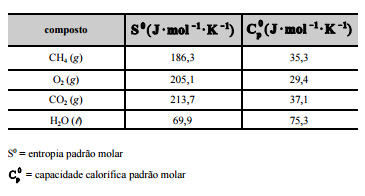
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.