Sobre as ligações químicas, analise as afirmativas.
I. Nas estruturas de Lewis, a ligação covalente resulta do compartilhamento de um par de elétrons entre dois átomos. Esse compartilhamento é uma característica particular das ligações encontradas na maioria das moléculas orgânicas.
II. Com o desenvolvimento da mecânica quântica, Linus Pauling introduziu o conceito de ressonância para explicar o tipo de situação, em que duas possíveis estruturas de Lewis coexistiriam sob a forma de estruturas ressonantes. Por exemplo, a representação das ligações no O3 é uma média de duas estruturas ressoantes possíveis.
III. Quando ocorre a ligação química pela transferência de elétrons de um átomo (que fica positivo) para outro átomo (que fica negativo), a ligação formada denomina‐se ligação iônica.
Está(ão) correta(s) a(s) afirmativas
No laboratório de química orgânica são realizados, constantemente, diversos processos químicos. Analise os dois processos que representam duas reações orgânicas muito comuns:
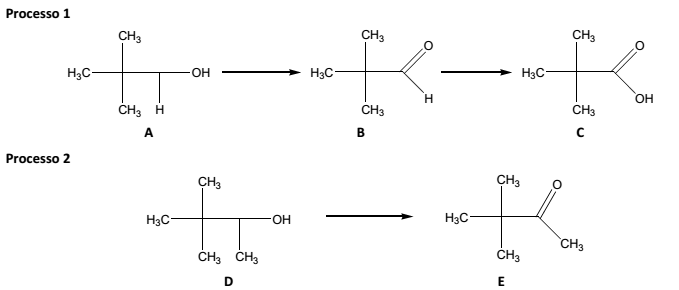
Diante do exposto, é INCORRETO afirmar que o composto
Numa titulação é preciso saber com precisão quando a solução que está sendo padronizada reagiu completamente com o padrão primário. Sobre o ponto final da reação, analise as afirmativas.
I. Ponto de equivalência ou ponto final teórico corresponde ao ponto da titulação em que é adicionada a quantidade de reagente padrão exatamente equivalente à quantidade de analito.
II. É calculado com base na estequiometria da reação envolvida na titulação.
III. Ponto final é o ponto da titulação onde ocorre uma alteração física associada à condição de equivalência. É indicado pela súbita mudança de alguma propriedade física da solução.
IV. A determinação do ponto final pode ser feita pelo uso de indicadores visuais que causam mudança na cor da solução num ponto muito próximo ao ponto de equivalência.
V. A determinação do ponto final pode ser feita, ainda, por métodos instrumentais e respondem a certas propriedades da solução, que mudam de características durante a titulação, tais como: medida de pH, condutividade, potencial, corrente, temperatura, absorbância etc.
Estão corretas as afirmativas
O estudo da tabela periódica mostrou que um grande número de propriedades físicas e químicas variavam conforme a variação do número atômico dos elementos químicos. Estas propriedades são as chamadas propriedades periódicas. Assinale a alternativa INCORRETA acerca das propriedades periódicas.
(Considere apenas elementos neutros e desconsidere os íons.)
Sobre as ligações químicas, assinale a afirmativa INCORRETA.
Os compostos binários, cujo elemento mais eletronegativo é o oxigênio, classificam‐se em: óxidos, peróxidos e superóxidos, em função do valor no número de oxidação (Nox) do átomo de oxigênio. Assinale a alternativa que apresenta somente peróxidos. (Considere apenas o conceito, independente de sua estabilidade ou não.)
Considere que os compostos com NaCl, LiBr, K2SO4, entre outros, são iônicos e formados a partir de íons (cátions e ânions) que se juntam para formar essas substâncias. São características (ou propriedades) típicas atribuídas aos compostos iônicos, EXCETO:
Sobre os ácidos inorgânicos, assinale a afirmativa INCORRETA.
Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) O potencial de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
Para facilitar o trabalho dos químicos, os compostos químicos foram dividos em diversas classes ou funções. Duas funções importantíssimas são os ácidos e as bases. Historicamente, os conceitos que definem os ácidos e as bases mudaram conforme a evolução dos conceitos e o entendimento da química. Diante do exposto, analise as afirmativas.
I. O sueco Svante Arrhenius recebeu o Prêmio Nobel de Química devido aos seus trabalhos de dissociação eletrolítica. Dentro destas teorias, tem‐se as seguintes definições: “ácido é toda substância química que, em água, libera como cátion exclusivamente íons H+” e “base é toda substância química que, em água, libera como ânions exclusivamente íons H+”. Trata‐se da teoria iônica.
II. Em 1923, Johannes Nicolaus Bronsted e Thomas Martin Lowry propuseram, independente, a teoria ácido‐base de Bronsted‐Lowry. Para eles, “ácido é toda substância que libera íons H+” e “base é toda substância que recebe (ou aceita) íons H+”. Trata‐se da teoria protônica.
III. Gilbert Newton Lewis, em 1916, foi um dos grandes responsáveis pelas explicações adequadas sobre as ligações covalentes, a partir do estudo do comportamento dos elétrons. Para Lewis, “ácido é toda substância capaz de aceitar (ou receber pares de elétrons) pares de elétrons de outra substância” e “base é toda substância capaz de doar (ou ceder pares de elétrons) pares de elétrons para outra substância”. Trata‐se da teoria eletrônica.
Está(ão) correta(s) a(s) afirmativa(s)
As substâncias que, quando colocadas em água, liberam, exclusivamente, ânions OH– , classificam‐se como bases de Arrhenius. Assinale a alternativa que contém apenas bases de Arrenhius.
Óxidos são compostos em que o elemento mais eletronegativo é o oxigênio com número de oxidação total e igual a – 2 (Nox = – 2). De acordo com o comportamento dos óxidos frente a outras substâncias, eles podem ser classificados em: ácidos, básicos ou anfotéricos. Assinale a alternativa que apresenta um óxido ácido.
Os compostos orgânicos, dependendo da função, podem apresentar características de ácidos. Evidentemente, são ácidos muito mais fracos que os ácidos inorgânicos. Assinale a alternativa que apresenta apenas compostos orgânicos com características ácidas
Um analista recebeu uma solução de NaOH 0,5 mol/L (NaOH – MM = 40 g/mol) para ser padronizada. Nesta padronização, foi usado, adequadamente como padrão primário, o ácido oxálico dihidratado (H2C2O4 . 2H2O – MM = 126,07 g/mol) convenientemente preparado. O analista mediu uma massa equivalente a 0,8303 g de ácido oxálico dihidratado e a diluiu em 100 mL de água em um Erlenmeyer, adicionando algumas gotas de fenolftaleína. O analista encheu uma bureta de 50 mL com a solução de NaOH e iniciou a titulação dos 100 mL da solução de ácido oxálico. O ponto de viragem, em que a fenolftaleína tornou‐se violeta, foi alcançado quando o volume NaOH da bureta era de 27,3 mL e a titulação parou. Assinale a alternativa que apresenta o valor da concentração padrão de NaOH.
Para padronizar uma solução, podem ser utilizados, no comércio, os seguintes padrões primários, EXCETO:

