A fórmula estrutural de um dos constituintes do jambu, erva típica da região Norte e muito apreciada na culinária paraense, é a seguinte:
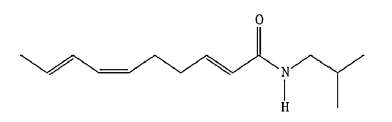
Sobre esta substância, faz-se as seguintes afirmativas:
I- possui a função amina,
II- apresenta 7 carbonos com hibridação sp²,
III- possui 23 átomos de hidrogênio,
IV- pode apresentar isomeria óptica,
V- apresenta a função amida.
Estão corretos os itens
Julgue as afirmativas a seguir, sobre o HCN.
I- Devido à eletronegatividade de seus elementos, possui geometria angular.
II- Sua base conjugada é o íon carboneto.
III- Trata-se de um composto covalente.
IV- Seu átomo de carbono tem hibridação sp3.
V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Ao adoçar 700 mL de suco de cupuaçu em uma jarra a 35 °C, uma pessoa utiliza 0,8 mols de glicose (C6H12O6), obtendo uma solução saturada sem corpo de fundo. Contudo, depois de ter colocado esta jarra em um refrigerador por duas horas, nota-se o acúmulo de uma certa quantidade de açúcar no fundo da jarra. Considerando que o coeficiente de solubilidade do açúcar no suco de cupuaçu é de 0,15 g/mL, e que as massas atômicas são C=12, H= 1 e O= 16, o número aproximado de mols de glicose não-dissolvidos a 0 °C é de
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente de polaridade dos compostos de I a V é
Uma alíquota de 15 mL de uma solução de Al(OH) 3 foi padronizada utilizando-se 0,15 miliequivalentes-grama de biftalato de potássio (hidrogenoftalato de potássio). Determinada a concentração da solução básica, 22 mL desta solução foram necessários para padronizar uma alíquota de 10 mL de H2SO4. Assim, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente:
Considerando-se que as massas molares em g.mol -1 são S=32, H= 1 e O= 16, a massa de H 2SO4 presente em 500 mL de solução é de, aproximadamente,
A velocidade é constante e não depende da concentração dos reagentes. Não existe uma relação direta entre os coeficientes e a ordem da reação. Essas são características cinéticas de reação de
A notação padrão de uma pilha de Daniel composta por zinco e cobre, considerando-se os potencias padrões de redução à 25ºC, E oZn2+= -0,76V e EoCu2+ = +0,34V, será
Analise as afirmativas a seguir sobre termoquímica.
I. Em uma reação endotérmica, a entalpia do sistema reativo cresce, ou seja, a entalpia dos produtos é maior do que a entalpia dos reagentes.
II. A lei da conservação de energia estabelece que a energia não é criada nem destruída em uma mudança de estado físico.
III. A variação de entalpia da reação depende do caminho que as reações ocorrem – Lei de Hess.
Está(Estão) correta(s) a(s) afirmativa(s)
Sobre a termoquímica, é correto afirmar que
Em uma situação hipotética, uma amostra de césio 137 (Z=55) foi transportada de Goiânia para análise em um laboratório em Belém e, durante a viagem, sofreu decaimento emitindo duas partículas alfa e quatro partículas beta. Assim, pode-se dizer que a amostra que o analista em Belém recebeu seria constituída por
Considere as substâncias a seguir.
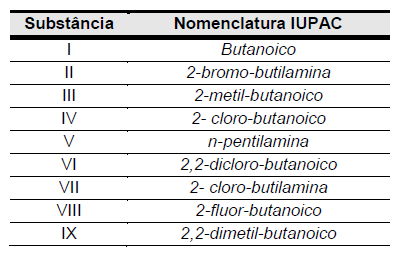
Se organizadas em ordem crescente de valores de pKa, temos a sequência
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente das substâncias de I a IX (excetuando-se as substâncias III e IV) em relação à tendência para receber um próton (H+) em uma reação ácido-base é

