Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
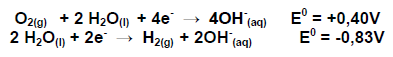
A reação global da pilha no estado padrão e seu valor do potencial padrão da pilha são, respectivamente,
A fórmula estrutural de um dos constituintes do jambu, erva típica da região Norte e muito apreciada na culinária paraense, é a seguinte:
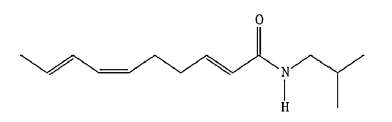
Sobre esta substância, faz-se as seguintes afirmativas:
I- possui a função amina,
II- apresenta 7 carbonos com hibridação sp²,
III- possui 23 átomos de hidrogênio,
IV- pode apresentar isomeria óptica,
V- apresenta a função amida.
Estão corretos os itens
Julgue as afirmativas a seguir, sobre o HCN.
I- Devido à eletronegatividade de seus elementos, possui geometria angular.
II- Sua base conjugada é o íon carboneto.
III- Trata-se de um composto covalente.
IV- Seu átomo de carbono tem hibridação sp3.
V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Ao adoçar 700 mL de suco de cupuaçu em uma jarra a 35 °C, uma pessoa utiliza 0,8 mols de glicose (C6H12O6), obtendo uma solução saturada sem corpo de fundo. Contudo, depois de ter colocado esta jarra em um refrigerador por duas horas, nota-se o acúmulo de uma certa quantidade de açúcar no fundo da jarra. Considerando que o coeficiente de solubilidade do açúcar no suco de cupuaçu é de 0,15 g/mL, e que as massas atômicas são C=12, H= 1 e O= 16, o número aproximado de mols de glicose não-dissolvidos a 0 °C é de
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente de polaridade dos compostos de I a V é
Uma alíquota de 15 mL de uma solução de Al(OH) 3 foi padronizada utilizando-se 0,15 miliequivalentes-grama de biftalato de potássio (hidrogenoftalato de potássio). Determinada a concentração da solução básica, 22 mL desta solução foram necessários para padronizar uma alíquota de 10 mL de H2SO4. Assim, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente:
Considerando-se que as massas molares em g.mol -1 são S=32, H= 1 e O= 16, a massa de H 2SO4 presente em 500 mL de solução é de, aproximadamente,
Assinale a opção correta no que diz respeito a transformações, reações e substâncias químicas.
O dióxido de enxofre (S02) e o dióxido de nitrogênio (N02), liberados, por exemplo, pela atividade industrial, podem reagir com o vapor d'água da atmosfera e originar o ácido sulfúrico (H2S04) e o ácido nítrico (HN03), respectivamente, sendo responsáveis diretamente pela(o):
Para a separação dos diferentes derivados do petróleo, as indústrias petroquímicas utilizam a:
O grau de insaturação de um ácido graxo é indicado pela( o):
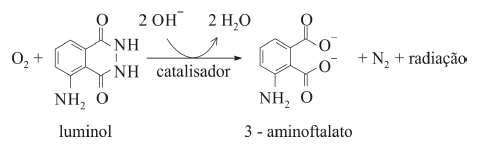
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
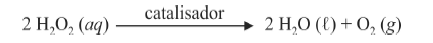
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Na molécula do luminol, os hidrogênios do grupo NH2 ligado ao anel aromático são mais ácidos do que os hidrogênios dos grupos NH presentes no segundo ciclo.
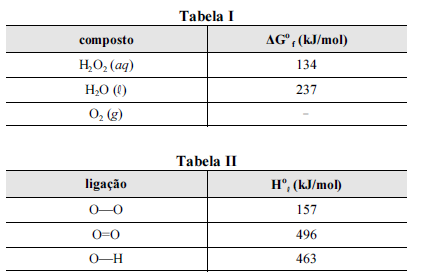
A seguir são apresentadas informações referentes à reação de decomposição do H 2O2.
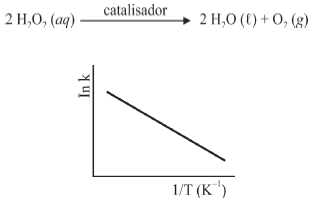
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é y = 30 - 3,0 × 10 4 x.
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGº f) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (Hº l), respectivamente.
Considerando que a reação de decomposição do H 2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue os itens subsequentes, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de equilíbrio da reação de decomposição do H2O2 é superior ao verificado em temperaturas mais baixas.
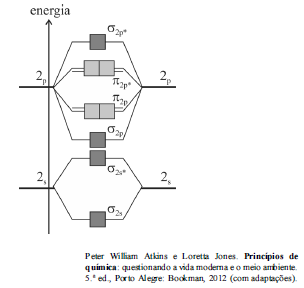
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2 + possui ordem de ligação maior do que a molécula neutra de O2.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
O rendimento quântico é uma medida da taxa de eventos induzidos pela radiação dividida pela taxa de absorção de fótons.

Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
O composto p-aminofenol é mais solúvel em água do que o composto 1-amino-4-metilbenzeno.