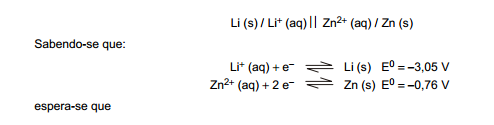Uma mistura gasosa a 27 oC constituída de 22,0 g de
propano (C3H8), 17,4 g de butano (C4H10) e 32,0 g de
metano (CH4) está contida num recipiente de 20L.
Considerando o comportamento ideal dos gases, dadas as
afirmativas seguintes,
I. A pressão parcial do metano é 0,6 atm.
II. A pressão total é 3,44 atm.
III. A fração em mol do butano é aproximadamente 0,5.
IV. A pressão parcial do propano é 0,615 atm.
V. A quantidade de matéria do propano é 0,11 mol.
verifica-se que estão corretas
Dados: C = 12; H = 1; R = 0.082 atm.L.mol-1.K-1
Em que classe de reação cada uma das seguintes
transformações está inserida?
Uma amostra de mármore foi mergulhada em uma solução de ácido muriático e, após alguns segundos, observou-se a formação de um gás. Na tentativa de conhecer a identidade desse gás, um experimentador borbulhou-o em uma solução A e observou a formação de um precipitado. As identidades do gás, liberado na reação descrita, e da solução A, responsável pela formação do precipitado, são, respectivamente:
O ambiente do laboratório exige conhecimento sobre regras de segurança fundamentais para prevenções de acidentes. Considere as seguintes afirmações sobre regras de segurança.
I. O armazenamento de substâncias em capelas deve ser feito respeitando as regras de compatibilidade entre reagentes.
II. São considerados EPIs utilizados em laboratórios de ensino: óculos de segurança, máscara de proteção respiratória com filtro adequado, luvas e aventais de algodão.
III. As soluções preparadas em laboratório devem ser rotuladas contendo no mínimo as seguintes informações: nome da solução, fórmula química da substância, concentração, data de preparação e nome do responsável pela preparação.
IV. O transporte de frascos grandes contendo produtos químicos deve ser feito com o uso de carrinhos de transporte. No caso de frascos de dimensões intermediárias deve-se segurá-los com cuidado e, de preferência, apoiando-os junto ao corpo.
Estão corretas somente as afirmações:
A organização de um almoxarifado de produtos químicos requer o conhecimento das principais propriedades dos materiais, principalmente com relação às incompatibilidades entre diferentes substâncias. Assinale a alternativa em que ambas as substâncias devem ser mantidas fora do contato com o ácido sulfúrico, devido a forte reação possível de acontecer.
Analise a estrutura de uma substância representada a seguir:
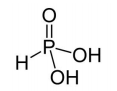
Assinale a alternativa que possui dados corretos referentes à substância citada.
Um técnico de laboratório preparou 1,0 L de solução aquosa de ácido clorídrico 1,2 mol/L para ser utilizada em uma aula prática de química. A solução foi preparada a partir da diluição de uma solução de ácido clorídrico concentrado. No rótulo do frasco de ácido concentrado utilizado constavam as seguintes informações: densidade 1,18 g/mL e teor de 37% em massa de HCl. O volume de ácido clorídrico concentrado, em mL, utilizado pelo técnico na preparação da solução diluída de HCl, foi igual a:
Certa solução aquosa a 25°C apresenta [OH-] = 10 -10 mol/L. Essa solução apresenta pH:
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 molL1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
Uma solução contém íons zinco, Zn2+ (aq), em concentração 0,01 mol/L. Para que a solução fique saturada a 25 °C, sem
precipitado de ZnS (s), a concentração do ânion sulfeto, S2- (aq), deve ser igual a
Dos processos abaixo, o único considerado endotérmico é a
Para testar o teor de álcool em uma amostra de gasolina colocaram-se, em uma proveta de 100 mL, 50,0 mL de gasolina e, a seguir, adicionaram-se 50,0 mL de uma mistura de solução de NaCl a 10% (m/v). Após agitação, a mistura foi deixada em repouso por 10 minutos para a separação das fases. Verificou-se que a fase correspondente à gasolina foi reduzida em 13,5 mL. O teor de álcool encontrado na amostra de gasolina, em porcentagem (v/v), foi
Uma reação em que há transformação do dióxido de carbono em monóxido de carbono é representada pela equação:
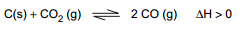
Pelo princípio de Le Chatelier,
O iodo é um sólido cristalino, cinza, brilhante. No aquecimento de seus cristais, origina-se um gás violeta. A mudança de estado físico descrita para o iodo é
Considere a seguinte célula galvânica, no estado padrão: