Um litro de solução de ácido perclórico, HClO4, de pH = 2,0, foi diluído com água até o dobro do volume inicial. O pH da nova solução

Considere um composto do tipo MX, onde M é um metal alcalino e X é um halogênio, pertencentes ao 2o
período da Tabela Periódica. Esse composto
Átomos de mesmo elemento que ganham estabilidade ao perder elétrons tendem a se unir entre si por ligação
Atenção: A tabela a seguir se refere às questões de números 49 a 51.
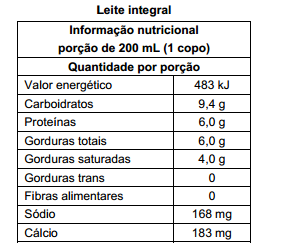
Dançar durante uma hora consome, para uma pessoa de 70 kg, 1 670 kJ de energia. Para recompor essa quantidade de
energia, seria necessário consumir um volume de leite integral, em mL, de, aproximadamente,
Segundo as Orientações Pedagógicas da Proposta Curricular do Estado de Minas Gerais, o ensino de Química deve utilizar experimentações como, por exemplo,
Utilizando uma corrente de 100 mA, a eletrodeposição de 1,0 g de níquel a partir de Ni2+ (aq), sobre uma bijuteria de aço inox
levaria o tempo, em minutos, de
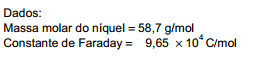
William Justin Kroll, em 1946, mostrou que o titânio podia ser obtido comercialmente pela redução do TiCl4 com magnésio
metálico. No processo Kroll, representado pela equação de óxido-redução não balanceada
A constante de equilíbrio da decomposição 2 J→X + L é de 0,0400 a uma dada condição reacional. Certa quantidade de J foi decomposta, e a concentração da substância L no equilíbrio foi determinada, encontrando-se 0,250 mol.L1. Nessas condições, a concentração de J no equilíbrio, em mol.L-1, é de
Um gás ideal ocupa uma caixa de volume V a uma pressão P e temperatura T = 300 K. Realizam-se três processos em sequência sobre esse gás: primeiramente, dobra-se a pressão a volume constante; em seguida, dobra-se o volume à pressão constante; finalmente, realiza-se um processo a volume constante, de modo que a pressão final é igual à pressão inicial P.
A temperatura final, em K, é
A figura apresenta substâncias orgânicas.
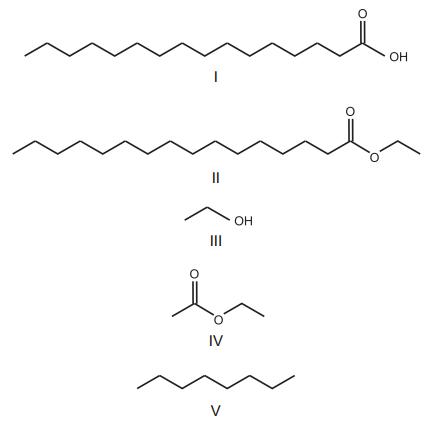
Considerando-se essas substâncias, verifica-se que os biocombustíveis estão representados em:
Considere que a reação química genérica abaixo
ocorra com um rendimento de 100%.
3A(g) + 5Y(g) → W(g)
O volume do gás Y necessário para reagir com
1,5 mol do gás A a uma temperatura de 27ºC e
pressão de 16,4 atm é de:
Dado: R: 0,082 atm.L.mol-1.K-1
Qual o pH de uma solução de um ácido fraco,
monoprótico de concentração 2 mol/L.?
Dado: Ka = 1,8.10-5 a 25ºC, log 6 = 0,78
Assinale a alternativa que contém a geometria dos respectivos íons: carbonato, nitrito, sulfato, clorato e perclorato.
A reação química abaixo possui um ΔH= – 312
kJ/mol.
CH4(g) + 3 Cl2(g) → HCCl3(g) + 3HCl(g)
Dados: Energia de ligação (valores médios): C – H: 413
kJ/mol, H – Cl: 431 kJ/mol, C – Cl: 328 kJ/mol. A energia em módulo da ligação covalente na
molécula Cl2(g) é:
Assinale a alternativa que corretamente apresenta espécies isoeletrônicas.

