No que concerne às biomoléculas, assinale a alternativa correta.
A respeito do ensino da química, assinale a alternativa correta.
No que concerne à química presente em nosso cotidiano, assinale a alternativa correta.

Texto 8A1-II
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa reação apresentem comportamento ideal e que a lei de velocidade para a reação seja dada pela equação v = k × [SO2Cl2]. Considere também que, na temperatura em que a reação ocorre (T), a constante de equilíbrio (Keq) da reação valha 0,40.
De acordo com a reação apresentada no texto 8A1-II, o tempo de meia vida (t1/2) do SO2Cl2 (g), entendido como o período de tempo necessário para que a concentração da espécie caia à metade da concentração inicial, pode ser calculado por meio da expressão
A combustão do metanol, combustível usado nos carros da Fórmula Mundial, produz uma chama invisível a olho nu, que libera ondas na faixa
A Lei n.º 14.238, de 19 de novembro de 2021, instituiu o Estatuto de Pessoa com Câncer, que estendeu à pessoa com câncer clinicamente ativo o direito à prioridade equivalente a várias garantias concedidas aos idosos, às gestantes e às pessoas com deficiência. Seus objetivos incluem reduzir a incidência da doença por meio de ações de prevenção e fomentar a criação e o fortalecimento de políticas públicas de prevenção e combate ao câncer.
Considerando esse contexto, sabe-se que o número de compostos comprovadamente carcinógenos para os seres humanos é muito pequeno. Em alguns casos, os compostos químicos são considerados carcinógenos com base em estudos epidemiológicos com humanos expostos. Um exemplo bem documentado é o cloreto de vinila, que possui a seguinte fórmula:
Considerando que o ponto de equivalência de uma titulação corresponde ao ponto estequiométrico, ou seja, o momento em que a quantidade de matéria do titulante se iguala à quantidade de matéria do titulado. O ponto final de uma titulação, por sua vez, pode ser corretamente definido como o momento em que
Considere que, em um recipiente de 2 L, esteja acontecendo a reação química ilustrada no gráfico a seguir.
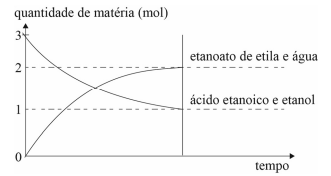
Nesse caso, a constante de equilíbrio da reação em apreço é igual a
Atenção: Para responder às questões de números 41 e 42, considere as informações abaixo.
As baleias são os maiores seres vivos do planeta e importantes recicladores de nutrientes dos oceanos. Elas consomem uma quantidade colossal de alimento e suas fezes fertilizam as águas próximas à superfície. Por exemplo, uma baleia azul come cerca de 16 toneladas de peixes, lulas e pequenos crustáceos por dia. Hoje, apenas no oceano Austral, as baleias reciclam por ano, 1 200 toneladas de ferro, nutriente essencial para a reprodução do plâncton, organismos microscópicos que estão na base da cadeia alimentar marinha e contribuem para captar gás carbônico da atmosfera.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
Considerando que o ferro reciclado pelas baleias no oceano Austral anualmente esteja na forma de íons Fe3+ a massa de íons cloreto necessária para neutralizar toda sua carga elétrica é, em toneladas, de, aproximadamente:
Atenção: Para responder às questões de números 47 e 48, considere o esquema a seguir que mostra as estruturas da sacarose e da sucralose.
As funções orgânicas comuns à sacarose e à sucralose são
O pó branco usado pelos palhaços para deixar o rosto bem branco é o óxido de zinco, um óxido anfótero que também pode ser usado como protetor da pele, evitando queimaduras solares e assaduras. Além da água, os produtos obtidos na reação desse óxido com o ácido clorídrico e com o hidróxido de sódio, são, respectivamente,
Considere o diagrama de energia para a reação X + Y → Z.
Os intervalos I, II e III representam, correta e respectivamente,
As reações de neutralização possuem diversas funcionalidades. Entre elas pode-se destacar o tratamento de alguns problemas de saúde ou até mesmo o preparo de alimentos. Para que esse tipo de reação ocorra é necessária a interação de um ácido com uma base, que tem como produto
O número de mols presente em uma amostra de 262g de bicarbonato de sódio (NaHCO3) é aproximadamente
Dado: Massa Molar NaHCO3 = 84g/mol

