Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
O composto H3BO3 (massa molar = 61,6 g/mol) é um sólido branco cristalino que, ao ser solubilizado em água, forma o ácido bórico, um ácido monoprótico, que em dada temperatura apresenta Ka = 5 x 10–10. Nessa condição de temperatura, usando-se um balão volumétrico de 100 mL e água destilada para se preparar uma solução de ácido bórico com pH = 5,0, a massa de H3BO3 que deve ser pesada é igual a
O consumo exagerado de refrigerantes é preocupante, pois contribui para o aumento de casos de obesidade e diabetes. Considere dois refrigerantes enlatados, um comum e um diet, e que ambos possuam a mesma quantidade de aditivos, exceto pela presença de açúcar. O refrigerante comum contém basicamente água carbonatada e grande quantidade de açúcar; já o refrigerante diet tem água carbonatada e adoçantes, cujas massas são muito pequenas.
CAVAGIS, A. D. M.; PEREIRA, E. A.; OLIVEIRA, L. C. Um método simples para avaliar o teor de sacarose e CO2
em refrigerantes. Química Nova na Escola, n. 3, ago. 2014 (adaptado)
Entre as duas versões apresentadas, o refrigerante comum possui
No que se refere a conceitos aplicados à química, julgue os itens a seguir.
A destilação simples pode ser utilizada para separar líquidos com pontos de ebulição distintos.
Faz poucos dias que o céu ficou repleto de luzes e cores – a chegada de 2023. A virada do ano é sempre movimentada para o corpo de bombeiros, e um número expressivo de ocorrências envolve incêndios e queimaduras pelo manuseio irresponsável de fogos de artifícios. O show de cores no reveillon é resultado das transições eletrônicas ocorridas nos átomos, amplamente discutidas na evolução dos
modelos atômicos. Considere que, durante a comemoração de virada do ano, tenha ocorrido fogos com as seguintes cores: azul; verde; laranja; vermelho; e, amarelo.
Com base na composição do espectro visível da luz, amplamente reportada no ensino de química, a cor com maior comprimento de onda será
São espécies com interação íon-dipolo
Considerando os padrões físico-químicos e microbiológicos relativos à água potável destinada ao abastecimento das populações humanas, analise as afirmativas a seguir.
I. O intervalo aceitável para o valor de pH no sistema de distribuição se situa entre 6,0 e 9,5.
II. A determinação da cor, turbidez e teor residual de desinfetante deve ser realizada em todas as amostras coletadas para análises microbiológicas.
III. A concentração mínima de cloro residual deve ser de 0,2 mg/mL em toda a extensão do sistema de distribuição; nos pontos de consumo deve ser de 2 mg/mL.
IV. A coleta de amostras para pesquisa de coliformes totais e Escherichia coli em mananciais superficiais deve ser realizada mensalmente e o volume mínimo de amostra a ser analisado deve ser de 1.000 mL.
V. Na água tratada para consumo humano, o parâmetro microbiológico para coliformes totais e Escherichia coli usado como indicador de contaminação fecal e de eficiência de tratamento é “ausência em 0,1 L de amostra”.
Está correto o que se afirma apenas em
Analise as afirmativas a seguir.
I. A pesquisa de coliformes deve ser feita em amostras de águas mantidas sob refrigeração, por um período que não exceda 24 horas.
II. Para pesquisa de sulfatos e sulfetos, a amostra deve ser mantida sob refrigeração após adição de HNO3 para manutenção de pH acima de 8.
III. O HNO3 é utilizado na determinação de alumínio, cobre, zinco, manganês e ferro em amostras de água, a fim de obter valor de pH inferior a 2.
IV. A medida de O2 dissolvido em amostras de água deve ser realizada em até 24 horas após coleta, em amostras mantidas em temperatura ambiente.
V. Para pesquisa de coliformes deve ser adicionado 0,1 mL de solução de Na2S2O3 a 1,8% para cada 100 mL de amostra, contendo cloro residual após a autoclavação dos frascos.
Está correto o que se afirma apenas em

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Uma amostra contendo 100 mg de uma mistura de carbonato de cálcio e de óxido de cálcio foi analisada por termogravimetria com aquecimento até 800 ºC em atmosfera de ar. A termogravimetria é uma técnica analítica em que a amostra é aquecida em um forno acoplado a uma balança e a massa da amostra é medida durante o aquecimento. Ao término da análise, o resíduo final apresentou a massa constante de 89 mg.
O teor de carbonato de cálcio na amostra analisada corresponde a:

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
A reação do composto As2S5 sólido com uma solução concentrada de HNO3 resulta na formação do gás NO2, de água e dos íons SO42– e AsO4 3–em solução.
Nessa reação, a participação de 1 mol de As2S5 resulta na formação de___________ de moléculas de água e envolve a participação de___________ de elétrons.
As lacunas são preenchidas, correta e respectivamente, por
De acordo com a Constituição Federal, é competência dos municípios o gerenciamento dos serviços de limpeza e coleta dos resíduos urbanos (lixo). No entanto, há relatos de que parte desse lixo acaba sendo incinerado, liberando substâncias tóxicas para o ambiente e causando acidentes por explosões, principalmente quando ocorre a incineração de frascos de aerossóis (por exemplo: desodorantes,
inseticidas e repelentes). A temperatura elevada provoca a vaporização de todo o conteúdo dentro desse tipo de frasco, aumentando a pressão em seu interior até culminar na explosão da embalagem.
ZVEIBIL, V. Z. et al. Cartilha de limpeza urbana. Disponível em:
www.ibam.org.br. Acesso em: 6 jul. 2015 (adaptado).
Suponha um frasco metálico de um aerossol de capacidade igual a 100 mL, contendo 0,1 mol de produtos gasosos à temperatura de 650 °C, no momento da explosão.
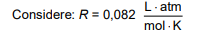
A pressão, em atm, dentro do frasco, no momento da explosão, é mais próxima de
É possível que algum candidato tenha na bolsa uma barra de chocolate, ou até mesmo balas, como fonte de nutriente. Nosso organismo, heterotrófico, precisa da glicose (C6H12O6) proveniente da alimentação para sobreviver e o hormônio da insulina deve estar presente, para permitir a entrada do carboidrato nas células. Uma empresa de táxi situada no centro da cidade convocou o corpo de bombeiros e o SAMU (Serviço de Atendimento Móvel de Urgência) para o resgate de um jovem de 315 kg que, devido a um mal súbito com desmaio, ficou preso entre os bancos de um dos automóveis da frota e não conseguia levantar-se sozinho. Após a análise médica e estabilização do paciente, foi constatado um quadro de hipoglicemia.
Se o nível de glicose do paciente for de 43 mg/dL (considere 1dL = 0,1 L), a conversão desta unidade de concentração em mmol/L de glicose resultará no valor aproximado de:
(Dados de massas molares: C = 12,0 g/mol; O = 16,0 g/mol; e, H = 1,0 g/mol.)
Em uma noite de segunda-feira, o Corpo de Bombeiros foi acionado para atender uma explosão ocorrida em um laboratório de ensino de química. Durante uma aula prática experimental, em que o professor demonstrava a síntese da água, a quantidade de gás hidrogênio (combustível) produzida foi elevada a ponto de ocasionar uma explosão no interior da capela, que se encontrava ocupada por bico de Bunsen em funcionamento. Com o acidente, ocorreu o derramamento de ácido e projeção de estilhaços de vidro. O professor e cinco alunos ficaram feridos e o local precisou ser interditado. No quadro de ensino constava a reação de síntese (não balanceada) a seguir:
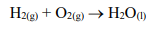
É CORRETO afirmar que, para 342g de gás oxigênio, a massa de gás hidrogênio necessária para a reação completa será aproximadamente de:

Tratando-se de reações de oxirredução, observe as semirreações a seguir:
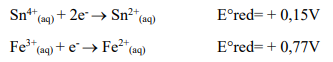
Considerando as semirreações, é CORRETO afirmar que a equação global balanceada da reação espontânea será:
Em uma titulação ácido-base, o analito é uma solução de uma base, e o titulante, a solução de um ácido, ou vice-versa.
Nesse contexto, o indicador, que é um corante solúvel em água, ajuda a detectar
Sobre os métodos titulométrico e gravimétrico para análises de água, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O objetivo do emprego de técnicas complementares na gravimetria é obter compostos estáveis e puros, passíveis de terem suas massas quantificadas.
( ) Precipitação, eletrodeposição, volatilização ou extração são métodos que substituem a gravimetria para a determinação da quantidade de sólidos em amostras de água.
( ) A determinação de prata em amostras de água por volumetria se fundamenta na titulação da amostra com excesso de NaCl ou KCl e formação de precipitado de AgCl, que é filtrado, lavado, dessecado e pesado.
( ) Na titulometria, a substância química de referência empregada no preparo da solução-padrão deve ser quimicamente estável, ter alto grau de pureza e não reagir com o analito presente na amostra.
( ) O precipitado formado em análises gravimétricas deve ser minimamente solúvel, a fim de assegurar que não ocorram perdas durante as etapas de filtração e pesagem, com quantidade remanescente recuperada e mensurada acima da sensibilidade da balança.
A sequência está correta em

