Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
No ensino de química, é sempre recomendável a abordagem da aula expositiva, preferencialmente utilizando-se recursos tecnológicos, como apresentações com projetores.
No que se refere a conceitos básicos de técnicas, materiais e normas de segurança laboratoriais, julgue o item subsequente.
Para se diluir ácidos concentrados, deve-se adicionar a água ao ácido lentamente e sob agitação.
No que diz respeito à relação professor-estudante no ambiente educativo, julgue o item subsecutivo.
A função docente requer um distanciamento emocional que garanta a autoridade do professor no contexto da sala de aula.
O cobre é um metal relativamente raro, empregado de diferentes maneiras, desde em fiações elétricas até mesmo na produção de ligas, como o bronze e o latão. Ele foi o primeiro metal a ser usado pelo Homem como substituto da pedra, na confecção de armas, ferramentas de trabalho etc. Estudos apontam que o cobre foi utilizado pelos povos que viviam na ilha de Chipre (cujo nome original era Cyprus - e, posteriormente, Cyprium) há mais de 6.500 anos, daí a origem do seu nome, Cuprum. Por essa razão, inclusive, o símbolo desse metal é Cu. Adaptado. Disponível em: Cobre: Ocorrência, obtenção industrial, propriedades e utilização - UOL Educação. Acesso: 05 de
janeiro de 2022.
Um dos minérios mais utilizados na obtenção do cobre metálico é a calcosita, que pode ser representada pela fórmula Cu2 S. Um método de retirada do enxofre do minério é o processo de ustulação (por meio de aquecimento em presença de ar seco, rico em gás oxigênio). Observe a equação não balanceada a seguir, que representa o processo citado anteriormente: oxigênio). Observe a equação não balanceada a seguir que representa o processo citado anteriormente:
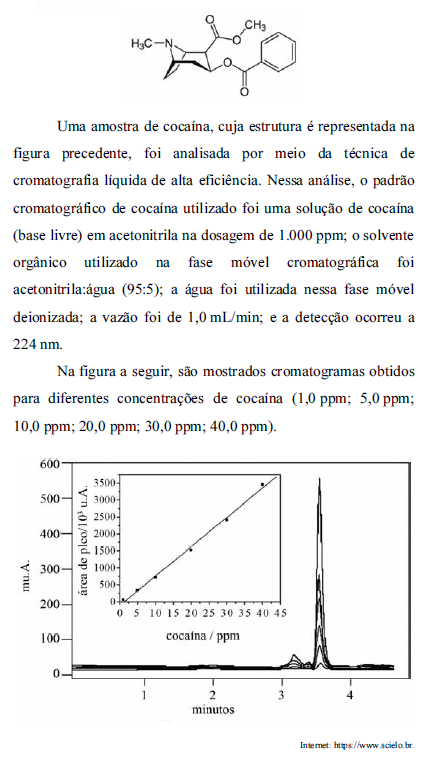
Após o balanceamento da equação anterior, assinale a alternativa que apresenta qual é a massa aproximada (em gramas) de cobre metálico que pode ser obtida a partir de 2,0 Kg de Cu2S, com 60% de pureza e gás oxigênio suficiente. (Dados: massas atômicas - Cu = 63,5; S = 32).
Tendo como referência essa situação hipotética, assinale a opção correta.
Considerando-se que, para titular completamente 10 mL de uma solução de ácido sulfúrico (H2SO4), tenham sido utilizados 15 mL de uma solução 1,2 mol/L de hidróxido de sódio (NaOH), conclui-se que a concentração em quantidade de matéria do ácido sulfúrico na solução analisada seria igual a
Ao realizar um processo de autoclavação em uma autoclave de geração elétrica de vapor, o manipulador percebe que os pacotes saem muito molhados. Assinale a alternativa que indica o provável problema a ser resolvido nesse equipamento.
Caso se deseje aquecer uma amostra de gás natural,
Texto 8A1-II
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa reação apresentem comportamento ideal e que a lei de velocidade para a reação seja dada pela equação v = k × [SO2Cl2]. Considere também que, na temperatura em que a reação ocorre (T), a constante de equilíbrio (Keq) da reação valha 0,40.
Considerando-se as informações do texto 8A1-II, se, inicialmente, houver SO2Cl2 (g) à pressão parcial inicial de 1,50 bar em um sistema fechado isento de SO2 (g) e Cl2 (g), então a pressão parcial do SO2Cl2 (g), quando atingido o equilíbrio químico à temperatura T, será igual a
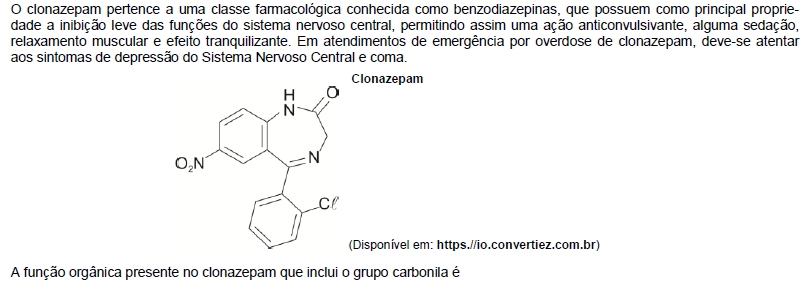
O número de oxidação (nox) deve ser determinado para cada átomo isoladamente. Os metais alcalinoterrosos, que apresentam nox igual a +2, incluem
Segundo a teoria de Brönsted-Lowry, um ácido
O ácido oxálico pode ser titulado com uma solução de permanganato de potássio (KMnO4), por meio da seguinte reação.
3 C2H2O4 + 2 MnO4 − ⇌ CO3 2− + 2 MnO2 + 3 H2O + 5 CO2
Considere que, na titulação de 10 mL de uma solução de ácido oxálico pelo método descrito anteriormente, tenham sido consumidos 25 mL de uma solução de KMnO4 0,0100 mol/L. Nesse caso, a concentração em quantidade de matéria de ácido oxálico na solução-problema é de
A equação seguinte representa a reação de decomposição da água.
H2O (g) ⇌ H2 (g) + 1/2 O2 (g)
Considere que, em um recipiente de 5 L, tenham sido adicionados 225 g de água e, em seguida, esse sistema tenha sido aquecido a 2.000 °C, sob pressão de 1 atm. Assumindo-se que, nesse caso, 70% da água será decomposta e que a massa molar da água (MH20) é igual a 18,0 g/mol, é correto afirmar que a concentração de água remanescente, após a situação de equilíbrio, será de
Assinale a alternativa que apresenta corretamente a hibridização dos átomos de fósforo nas seguintes espécies, respectivamente: PCl4+, PCl6−, PCl5 e PCl3.