Uma operação realizada pelo Corpo de Bombeiros, a fim de impedir um grave acidente em uma caldeira de uma indústria de bebidas, possibilitou revelar que a água que alimentava a caldeira apresentou um índice de dureza de 250 ppm (partes por milhão) de CaCO3. Considerando que a densidade da solução (amostra) é 1 g/cm3, é correto afirmar que
Um material biológico suspeito foi coletado em um indivíduo encontrado morto. No laboratório, esse material começou a ser analisado dentro dos procedimentos habituais. No entanto, em determinado momento, o frasco de vidro contendo o material biológico caiu da bancada e se quebrou ao atingir o piso. A partir desse momento, a atitude correta e imediata a se tomar é
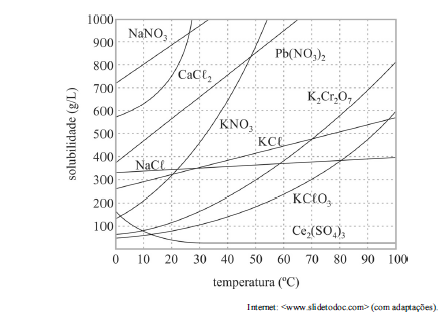
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.
O químico Walther Kossel desenvolveu a teoria eletrônica da camada de valência, em 1916, baseado na observação que a maioria das espécies atômicas se estabilizam ao possuir uma configuração eletrônica parecida com a configuração eletrônica da maioria dos gases nobres. A sua teoria ficou conhecida como regra do octeto.
Considerando a regra do octeto e os demais conhecimentos de química, assinale a alternativa correta.
As reações de ustulação são processos inorgânicos que podem dar origem a produtos como metais puros e óxidos metálicos. Nessas reações, sulfetos são submetidos a uma reação de combustão conforme disposto no exemplo a seguir:
x FeS2(g) + y O2(g) → zFe3O4(s) + w SO2(g)
Os números que representam corretamente os coeficientes estequiométricos x, y, z e w são, respectivamente,
As ideias sobre os átomos e sua composição passaram por diversas modificações ao longo dos anos. A partir de estudos, foram propostos alguns modelos que explicariam de que seria formada a menor parte que constitui a matéria. Analise a seguir os modelos propostos e seus respectivos cientistas responsáveis:
I. O átomo é uma esfera maciça, indestrutível e que pode ser dividido - Dalton
II. O átomo é uma esfera maciça de carga positiva encrustada de elétrons - Thomson
III. O átomo possui um núcleo positivo, com elétrons girando ao seu redor – Rutherford
A correlação entre o cientista e suas ideias está correta

A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão contidos 1,2 × 1022 íons de Na+.
As moléculas triatômicas participantes da reação supracitada possuem geometria linear.
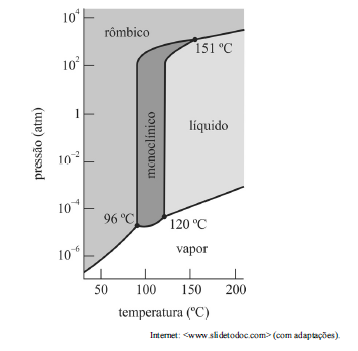
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
O diagrama de fases do enxofre possui três pontos triplos, mas não é possível observar a existência simultânea de quatro fases.
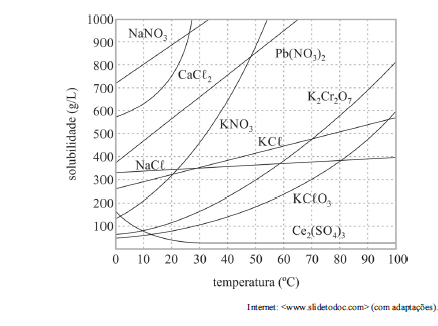
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
Em solução supersaturada, a concentração de soluto é superior à sua solubilidade a uma dada temperatura; mesmo assim, esse soluto permanece dissolvido após aquecimento e lento resfriamento do sistema.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua camada de valência.
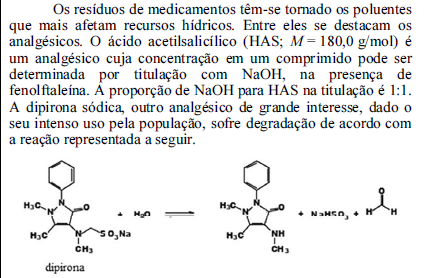
Com base nessas informações, julgue o próximo item.
A função da fenolftaleína nessa titulação é tamponar a solução.

Com base nessas informações, julgue o próximo item.
Se a taxa de produção de oxigênio (d[O2]/dt) for igual a 3,0 × 10−5 mol/s, a taxa de consumo de ozônio (d[O3]/dt) será igual a −2,0 × 10−5 mol/s.
O ibuprofeno (M = 206 g/mol) é um analgésico e anti-inflamatório produzido a partir do ácido 3-fenilpropanoico. Em relação ao ibuprofeno e seu precursor, julgue o item a seguir.
A reação do ácido 3-fenil propanoico com álcool forma um éster.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
Para que as atividades experimentais de química tenham sucesso, é fundamental que a escola detenha espaço físico e condições materiais adequadas para a execução dessas atividades, como um laboratório dotado de diversas substâncias químicas puras e equipamentos adequados para a realização dos experimentos, tais como vidrarias, materiais plásticos, porcelanas, ferragens, balança, estufa, banho-maria e placa de agitação magnética com aquecimento, entre outros.


