A densidade de uma amostra de vidro pode ser determinada pelo método de imersão, no qual o sólido é pesado cuidadosamente e, em seguida, transferido para um instrumento
volumétrico graduado, como uma proveta, parcialmente cheio de um solvente menos denso que a evidência coletada. Assim, o volume de líquido deslocado por ele é igual ao seu volume.
Por não ser destrutiva, essa técnica permite que os fragmentos sejam recuperados e utilizados em análises posteriores.
Com base nessas informações e dado que um fragmento de vidro recuperado em um local de crime tenha massa igual a 3,74 × 104 mg e o volume deslocado de líquido na proveta tenha sido de 0,0139 dm3, é correto afirmar que a densidade dessa evidência forense terá sido
Sabendo que uma solução de éter etílico — substância utilizada para compor a fase móvel da técnica de separação denominada cromatografia em camada delgada — apresenta ponto de fusão igual a −116,3 oC e ponto de ebulição igual a 34,6 oC a uma dada pressão P, julgue os itens a seguir, considerando essa mesma pressão P.
I A −140 oC o estado do éter etílico é sólido.
II A 23 oC o estado do éter etílico é gasoso.
III A 34,6 oC estarão presentes os estados sólido e líquido do éter etílico.
IV A −113 oC o estado do éter etílico é líquido.
Estão certos apenas os itens

A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
O cloreto de sódio é um composto iônico de estrutura cúbica de face centrada, com número de coordenação igual a 6 para cada íon.
Para a eliminação completa de 16 mg de metanfetamina do corpo, serão formados mais de 40 mg de gás carbônico, considerando-se um rendimento de 80% desse processo.
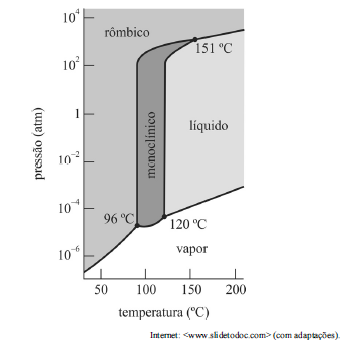
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
Quando submetido à pressão de 1 atm e à temperatura de 170 °C, o enxofre está na fase sólida.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O carbono assume número de oxidação negativo quando ligado a metais fortemente eletropositivos, como no caso do CaC2.
Com base nessas informações, julgue o próximo item.
O NaOH é um óxido básico binário.

Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de ozônio reage com o oxigênio atômico, é bimolecular.
O ibuprofeno (M = 206 g/mol) é um analgésico e anti-inflamatório produzido a partir do ácido 3-fenilpropanoico. Em relação ao ibuprofeno e seu precursor, julgue o item a seguir.
Para produzir 25,0 mL de solução aquosa de ibuprofeno com concentração igual a 0,50 mol/L, é necessário usar uma massa inferior a 2,0 g desse medicamento.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
Tanto nas atividades teóricas como nas experimentais, é imperativo que o professor resolva os problemas para os alunos e mostre a eles que só existe uma resolução possível para cada problema.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
No construtivismo, o professor não é visto como um simples detentor e transmissor do conhecimento, mas principalmente como um mediador que auxilia, dá suporte e estimula os alunos na construção de seus próprios conhecimentos. Os alunos, por sua vez, são vistos como sujeitos ativos nesse processo.
Julgue o item que se segue, relativos à avaliação de aprendizagem aplicada ao conhecimento químico.
Para os teóricos da avaliação de aprendizagem, avaliação e exame são sinônimos.
O petróleo é uma mistura de moléculas de carbono e hidrogênio que tem origem na decomposição de matéria orgânica, principalmente plâncton, formada por meio da ação de bactérias em ambientes com pouco oxigênio. No decorrer de milhões de anos, esse material se acumulou no fundo de oceanos, mares e lagos. Ao ser pressionado pelos movimentos da crosta terrestre, dá origem a mistura que chamamos de petróleo e que é utilizada em várias atividades industriais: combustíveis, tecidos, medicamentos, plásticos, automóveis, entre outras.
Adaptado. Disponível em: Petróleo: o que é e para que serve? - eCycle. Acesso: 06 de janeiro de 2022.
Observe as imagens a seguir.
Utilizando os dados contidos na questão e seus conhecimentos sobre a obtenção de combustíveis a partir do petróleo, assinale a alternativa correta que apresenta o processo de separação de misturas mais relevante durante a obtenção destes combustíveis e a propriedade física adequada utilizada para esta separação, respectivamente.
Preencha as lacunas e assinale a alternativa correta.
A normalidade indica o número de __________________ do ____________ em 1(um) litro de solução. Esta é calculada através do quociente entre o número de equivalente-grama(eg) de __________ dissolvidos e o _______________ de _________________ em litros.


