Considere os dois sistemas reacionais hipotéticos:
Das assertivas acima, está(ão) CORRETA(S ):
Considere as assertivas
Assinale a alternativa com as assertivas FALSAS.
A partir da reação hipotética não balanceada, X2(g) + M2(g) → Xm3(g), e considerando a temperatura de 127 0C e pressão igual a 8,2 atm, o volume necessário de M2(g) para reagir completamente com 2,34 g de X2(g) é (dados: X = 14 u):
O Princípio de Le Chatelier, também conhecido como Princípio de Le Chatelier-Braun, foi
formulado pelo químico francês Henri Louis Le Chatelier em 1884 dizendo que “Todo sistema
em equilíbrio químico estável submetido à influência de uma causa externa que tenda a fazer
variar, seja sua temperatura, seja seu estado de condensação (pressão, concentração,
número de moléculas numa unidade de volume), em sua totalidade ou somente em algumas
de suas partes, sofre apenas modificações internas, as quais se ocorressem isoladamente
acarretariam modificação de temperatura ou de estado de condensação de sinal contrário
àquela resultante da ação exterior”. Em 1888, Le Chatelier apresentou uma segunda
formulação, classificado por ele como uma lei puramente experimental, de uma forma mais
breve, simples e generalizada que diz que “Todo sistema em equilíbrio experimenta, devido à
variação de apenas um dos fatores do equilíbrio, uma variação em um sentido tal que, se
ocorresse isoladamente, levaria a uma variação de sentido contrário ao fator considerado”. Em
1908, Le Chatelier reapresenta sua segunda formulação “A modificação de algumas
condições que podem influir sobre um estado de equilíbrio químico de um sistema, provoca
uma reação em um sentido tal que tenda a produzir uma variação de sentido contrário à
condição externa modificada”. Observe atentamente os enunciados propostos a seguir para o
princípio de Le Chatelier (Química Nova na Escola; Vol. 32; n.2; 2010).
I. Se um sistema em equilíbrio for submetido a uma perturbação, haverá um deslocamento
nesse equilíbrio no sentido de maximizar o efeito da mudança.
II. Quando um sistema em equilíbrio sofrer algum tipo de perturbação externa, ele se
deslocará para minimizar essa perturbação, a fim de atingir novamente uma situação de
equilíbrio.
III. Quando uma perturbação interna é imposta a um sistema químico em equilíbrio, esse
equilíbrio irá se deslocar de forma a minimizar tal perturbação.
IV. Quando uma perturbação é imposta a uma transformação em equilíbrio, este é rompido por
um curto espaço de tempo, estabelecendo-se a seguir novo estado de equilíbrio. Como
resposta à perturbação, ocorrerá a formação ou de maior quantidade de produtos ou de
maior quantidade de reagentes, estabelecendo-se um outro estado de equilíbrio. Nessa
nova situação de equilíbrio, a concentração do produto poderá ser maior ou menor,
dependendo da perturbação imposta.
V. Se um sistema está em equilíbrio e alguma alteração é feita em qualquer das condições de
equilíbrio, o sistema reage de forma a neutralizar ao máximo a alteração introduzida.
VI. Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no
sentido de aumentar os efeitos dessa força.
Em quais enunciados propostos NÃO ocorre semelhança em relação aos enunciados
originais de Le Chatelier.
O gasoduto Brasil-Bolívia foi construído para transportar uma capacidade de 30 milhões de
metros cúbicos diários de gás. Esse gasoduto possui uma extensão de 557 km do lado
boliviano e 2593 km do lado brasileiro. É o maior projeto de gás natural construído na América
Latina. Uma empresa precisa proteger sua tubulação de gás. Ela enterra a tubulação num solo
de baixa resistividade elétrica e protege catodicamente contra a corrosão. A área da tubulação
sob proteção é de 900 m2 e está submetida a uma densidade de corrente de proteção de 15 mA m-2 pela aplicação de corrente elétrica proveniente de um gerador de corrente contínua.
Considere que a polaridade do sistema de proteção catódica seja invertida durante 30
minutos. Calcule a massa aproximada, em gramas, de ferro consumida no processo de
corrosão em função de íons Fe2+(aq). Admita que 80% da corrente total fornecida pelo gerador
será consumida no processo de corrosão da tubulação.
Leia atentamente as informações referentes às propriedades periódicas.
I. Os cátions são menores que os átomos que lhes dão origem; já os ânions são maiores que
os átomos que lhes dão origem.
II. A energia de ionização de um átomo ou íon é a mínima necessária para remover um
elétron de um átomo ou íon gasoso isolado no seu estado fundamental.
III. A afinidade eletrônica é a variação de energia que ocorre quando um elétron é adicionado
a um átomo gasoso.
Assinale a alternativa com a assertiva CORRETA:
Assinale a alternativa com a assertiva FALSA:
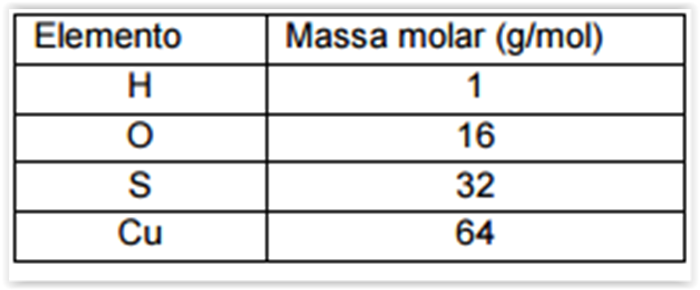
Em um recipiente de volume constante foi efetuada a reação de
decomposição:
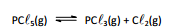
Inicialmente a pressão parcial do pentacloreto de fósforo era de
2,0 bar. A atingir o equilíbrio foi constatada uma porcentagem de
decomposição de 98%.
Se esse sistema em equilíbrio for perturbado pela adição de
0,01 mol de gás cloro, mantendo-se constante as condições
anteriores, quando o novo equilíbrio for atingido
A indústria química utiliza a fluorita (CaF2)para a obtenção do flúor elementar, de diversos produtos químicos designados genericamente de fluoroquímicos e do ácido fluorídrico (HF). O fluoreto de cálcio apresenta baixa solubilidade em água e sua constante do produto de solubilidade a 25C, é 3,9 x 10–11. A solubilidade do fluoreto de cálcio em uma solução 0,10 mol.L–1 de fluoreto de sódio nessa temperatura é, em mol.L–1:
As cirurgias no globo ocular geram dor e, em alguns casos, inflamação após procedimento. Um anestésico de ação local, a base de proparacaina,
tem sido utilizado nestas intervençõess e tem diminuido as complicagoes no pos-operatorio. Um método de síntese da proparacaina envolve inicialmente
a reação:
H A estrutura do composto representado por A é: 0
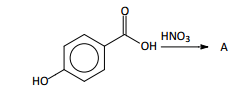
Uma ampla variedade de compostos químicos utilizados como
herbicida apresenta alto potencial de contaminação de águas
subterrâneas.
Os compostos, cujas estruturas estão representadas acima, fazem
parte de uma formulação comercializada para aplicação em
cultivos de trigo e cevada.
Analise as estruturas e assinale a afirmativa correta.
A célula eletroquímica hipotética, representada por
X (s) │ X2+ (1,00 mol.L–1) ││ Cu2+ (0,01 mol.L–1) │ Cu (s)
apresentou potencial igual 0,686 volts.
Esta célula hipotética foi construída por duas semi‐células, uma
formada por um eletrodo desconhecido imerso em uma solução
de concentração 1,00 mol.L–1 contendo seus cátions X´2+ e outra
formada por um eletrodo de cobre imerso em uma solução
diluída com íons Cu2+ na concentração 0,01 mol.L–1.
Nas condições do enunciado, os eletrodos apresentam os
potenciais padrão:
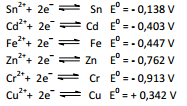
Nestas condições, X é o
Para realizar uma reação, um técnico precisava de 4 mols de
cobre II. No entanto, só dispunha de sulfato de cobre II penta
hidratado (CuSO4 . 5 H2O) em seu estoque. Considere os
dados a seguir para calcular a massa de sal hidratado que o
técnico deverá usar para fazer a reação.
Dados: Massas Molares
A massa de sal hidratado encontrada está identificada na
alternativa:
Assinale a alternativa que apresenta as vestimentas adequadas para o trabalho em um laboratório de química:
Assinale a alternativa que identifica o processo de passagem da água para o gelo.