A benzofenona é um composto orgânico utilizado em cosméticos para prevenir a degradação desses produtos pela luz ultravioleta e também pode ser adicionada a embalagens plásticas com o objetivo de bloquear os raios UV e proteger o produto. Para avaliar a contaminação de uma amostra de benzofenona com fenil-propanona foi utilizada a técnica de infravermelho. Considerando as absorções na região do infravermelho, os dois compostos podem ser distinguidos através da deformação
O Bi3+ pode ser determinado através da formação de BiOI
(oxiiodeto), neste método a solução fria contendo nitrato de
bismuto (III) deve ser levemente acidulada com ácido nítrico e em
seguida deve ser feita lentamente e com agitação, a adição de
iodeto de potássio na forma de pó para que ocorra formação do
BiI3 (triiodeto de bismuto) que em seguida é fervido com água
quente. Neste procedimento é formado um precipitado de BiOI
cor de cobre que deve ser filtrado, lavado com água e secado a
cerca de 110o
C até peso constante e em seguida pesado.
Utilizando o método descrito em condições apropriadas, a
quantidade de Bi3+ em uma amostra contendo nitrato de bismuto
(III) foi determinada através da formação de um precipitado de
BiOI, que após lavagem e secagem pesou 0,1g. Nestas condições,
a massa (em miligramas) de Bi3+ presente na amostra é,
aproximadamente:
Dados: Massa molares (g.mol–1) Bi = 209; Bi(NO3)3 = 395 e BiOI = 352
No Complexo Estuarino Lagunar Mundaú-Manguaba (Alagoas), de grande importância socioeconômica, foi coletada uma amostra de água e determinou-se a presença apenas dos seguintes íons: K+, CleSO4-2M/sup> Se, nesta solução, as concentrações dos íons K+ e SO4-2M/sup>, são respectivamente, 1,95 g dm-3e 0,96 g dm-3, a concentração, em mol L-1, de íons Clserá:
Considere as assertivas:
Assinale a alternativa com as assertivas VERDADEIRAS:
A primeira comunicação oral de Dalton, a respeito de sua teoria, foi lida por ele na Sociedade
Literária e Filosófica de Manchester, em 21 de outubro de 1803. Sua publicação deveu-se
inicialmente a seu amigo Thomas Thomson (1773 - 1852) que, após ouvi-la do autor em 1804,
decidiu apresentá-la, com o devido crédito, em seu livro System of Chemistry, publicado em
1807 . Thomson, em sua detalhada descrição da teoria de Dalton, usa a palavra átomo e
também os símbolos inventados por ele para representar os átomos de sua teoria. Esta veio a
ser publicada pelo próprio Dalton em sua obra principal, saída à luz a partir de 1808, o New
System of Chemical Philosophy (Quimica Nova na Escola, n.20, 2004). Dalton fez muitas
medidas da razão das massas dos elementos que se combinavam para formar compostos e
foi capaz de detectar razões de massas consistentes que o levaram a desenvolver sua
hipótese atômica.
A seguir considere as assertivas:
I. Todos os átomos de um dado elemento são idênticos.
II. Os átomos de diferentes elementos têm massas diferentes.
III. Um composto é uma combinação específica de átomos de mais de um elemento.
IV. Em uma reação química, os átomos não são criados nem destruídos mas trocam de
parceiros para produzir novas substâncias.
Assinale a alternativa com as assertivas VERDADEIRAS:
Considere a reação entre o dióxido de enxofre e o oxigênio produzindo trióxido de enxofre todos no estado gasoso. Estabelecido o equilíbrio temos as concentrações, em mol L-1, dos reagentes iguais e a do produto com valor igual a 0,00750. Sabendo que a constante de equilíbrio é igual a 0,0422, calcule o valor da concentração dos reagentes.
Um prego de ferro pesando 2,0 gramas é imerso num copo de béquer contendo solução aquosa de ácido clorídrico. Após certo tempo observa-se a dissolução do prego e a formação de bolhas gasosas sobre a superfície metálica. Supondo que durante o tempo em observação 40% do prego sofreu oxidação. Calcule o volume aproximado de gás hidrogênio formado, admitindo-se que a temperatura é mantida constante e igual a 25 oC e que a base do béquer está posicionada ao nível do mar.
Os metais alcalinos são sólidos metálicos maleáveis. Todos têm propriedades metálicas características, como brilho metálico prateado e altas condutividades térmicas e elétricas. Os metais alcalinos reagem violentamente com água, produzindo gás hidrogênio e soluções de hidróxidos de metais alcalinos. Supondo que 0,50 g de sódio metálico sejam adicionados dentro de um béquer e reaja completamente com exatos 30cm3 de água. A concentração aproximada em quantidade de matéria, em mol L-1, da solução básica remanescente é:
Considere a reação química representada pela seguinte equação: NO2(g) + O2(g) → N2O5(g). Num determinado instante de tempo t da reação, verifica-se que o oxigênio está sendo consumido a uma velocidade de 1,2 x 10-3 mol L-1 s-1. Nesse tempo t, a velocidade de produção de N2O5 será de:
Para elaborar uma curva de calibração de um determinado aparelho, um técnico utilizou uma solução padrão de fluoreto com uma concentração igual a 1000 mg/L. A partir dessa solução padrão, o técnico em questão preparou 1L de solução com concentração igual a 50mg/L e 500 mL de uma solução com concentração igual a 2 mg/L. Durante a preparação dessas soluções, devem ser utilizadas pelo técnico as seguintes vidrarias:
Durante um experimento, um químico que utilizava um recipiente fechado, indeformável e cuja atmosfera era de nitrogênio, gostaria de aumentar a pressão do sistema para verificar os efeitos em sua reação. Assinale a alternativa que explicita o modo como o químico pode elevar a pressão do sistema em questão:
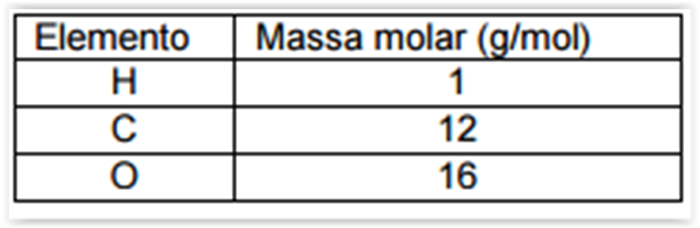
Para determinar a concentração de ácido acético (C2H4O2) em
uma amostra de vinagre, foram titulados 20 mL do vinagre
com 10 mL de solução 0,01 mol/L de NaOH, previamente
padronizada. A concentração encontrada foi de:
Dados: Massas Molares
Podemos definir o processo de sublimação como sendo:
Associe os métodos físicos de análise utilizados na química
inorgânica às suas respectivas definições:
I Espectroscopia ultravioleta-sensível
II Espectroscopia infravermelha e Roman
III Ressonância magnética nuclear
IV Espectroscopia de massa
(___) É o método pelo qual se pode medir a razão massacarga
de um íon gasoso. Os íons podem ser
carregados positiva ou negativamente. Normalmente
deduz-se a carga de um íon e, portanto, a massa da
espécie.
(___) É o método espectroscópico mais poderoso e mais
usado para a determinação de estruturas moleculares
em solução e de líquidos puros. Em muitos casos, o
método em questão fornece informações sobre a
forma e a simetria com maior confiabilidade quando
comparado a outras técnicas.
(___) Trata-se do método pelo qual se realiza a observação
da absorção de radiação eletromagnética nas regiões
do visível e do ultravioleta do espectro. É muitas
vezes chamada de espectroscopia eletrônica, pois a
energia é utilizada para excitar espécies para níveis
de energia eletrônicos mais altos.
(___) Trata-se do método utilizado para caracterizar
compostos em termos da força e do número de
ligações que estão presentes. É usado também para
detectar a presença de compostos conhecidos,
acompanhar as variações de concentração de uma
espécie durante uma reação, e determinar os
constituintes de um composto desconhecido, entre
outras funções.
Assinale a alternativa que apresenta a ordem CORRETA de
correlação de cima para baixo:
A cal viva é um material muito usado por pedreiros, pintores e agricultores, representada pela fórmula CaO. Assinale a alternativa que nomeia corretamente a função representada.