Em 1928, as equações matemáticas do físico inglês Paul Dirac previam que alguns núcleos radioativos poderiam emitir uma partícula com a mesma massa do elétron, mas com carga positiva. Essa partícula foi denominada:
“Uma alternativa à geração de energia através da combustão
do etanol é utilizá−lo como uma fonte de hidrogênio. O
hidrogênio produz energia e água em uma célula a combustível
e essa energia pode ser calculada através do ciclo de energia
global apresentado a seguir.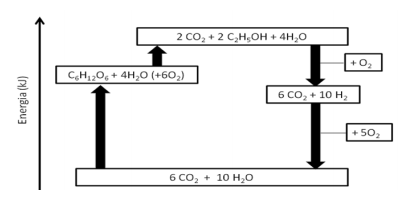
Neste ciclo o processo de fotossíntese gera glicose (C6H12O6) a
partir de CO2 e H2O com absorção de 2540 kJ para cada mol de
glicose produzido. Um mol de glicose é então convertido em 2
mol de etanol absorvendo 20 kJ. Na continuação do processo,
um mol de etanol produz H2 liberando 70 kJ por mol de etanol.”
(KOTZ, J.C., TREICHEL, P.M., WEOVER, G.C.. Química Geral e reações químicas
vol.1. São Paulo: Cengage Learning, 201p.251. Adaptado)
Considerando todo o processo descrito, a energia liberada na
conversão de hidrogênio em água, em kJ.mol–1, é igual a
Os avanços tecnológicos na eletrônica, no início do século XX, levaram à invenção do espectrômetro de massas, um aparelho capaz de determinar a massa de um átomo. Quando os cientistas usaram espectrômetros de massas descobriram que átomos de um mesmo elemento apresentavam massas diferentes. O espectro de massas de uma amostra de neônio (Z=10) perfeitamente puro está representado na figura a seguir.
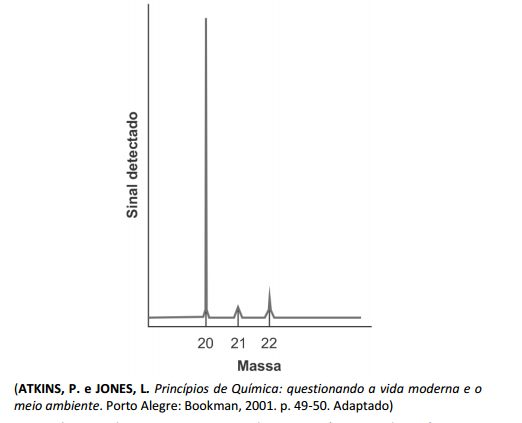
Assinale a alternativa que indica o número de nêutrons encontrado no núcleo do átomo que apresenta sinal de maior intensidade.
Diferentemente de outros elementos transurânicos, descobertos como resultado de um longo e cuidadoso planejamento (...) os elementos 99 e 100 foram descobertos “acidentalmente”, tendo sido gerados em uma explosão termonuclear em 1952.
A síntese desses novos elementos deu−se pela captura de nêutrons por parte do Urânio−238, seguida de emissão de partículas beta.
(FARIAS,R.F. Para gostar de ler a História da Química, 3° ed.Campinas, SP: Editora Átomo, 2008, p.73. Adaptado)
A emissão de partículas beta negativa nesse processo ocasionou
A qualidade de um corpo d'água foi monitorada, durante
quatro meses, pelo parâmetro concentração de fosfato.
As concentrações deste ânion, em mg.L–1, foram determinadas
utilizando a mesma metodologia e os valores obtidos estão
apresentados no gráfico a seguir:
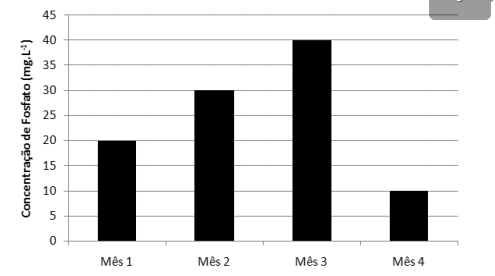
De acordo com o gráfico, a concentração média de fosfato em quantidade de matéria (mol.L–1) no corpo d'água, durante os meses avaliados, é aproximadamente de
Dados: Massas Molares (g.mol–1) O = 16 e P =31
O modelo de repulsão dos pares de elétrons da camada de
valência (modelo VSEPR) baseia–se na ideia de que as regiões
de altas concentrações de elétrons (ligações e pares isolados do
átomo central) se repelem e, para reduzir essa repulsão, elas
tendem a se afastar o máximo possível, mantendo a mesma
distância do átomo central. Aplicando essa teoria, a geometria
prevista para a molécula de pentacloreto de fósforo é
Dados: P (Z=15) e Cl (Z=17)
A vitamina B5, encontrada em diversos alimentos, é importante para a saúde humana, pois ajuda a controlar a capacidade de resposta do corpo ao stress, além de aturar na produção dos hormônios nas glândulas suprarrenais, na formação de anticorpos e no metabolismo das proteínas, gorduras e açucares.
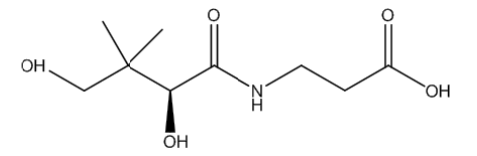
A estrutura química da vitamina B5, representada na figura, apresenta grupos funcionais que identificam as funções.
A ureia, utilizada como fertilizante, pode ser produzida através da reação de amônia líquida com o CO2 gasoso, em um reator de síntese, ocorrendo inicialmente a formação do carbamato de amônio que posteriormente se decompõe parcialmente em ureia e água. O carbamato de amônio não reagido é decomposto em amônia e CO2 num processo endotérmico segundo a equação:
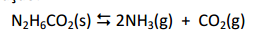
Em relação ao equilíbrio apresentado, a reação de decomposição do carbamato é favorecida pela
Para que a água consumida domiciliarmente possa chegar aos consumidores em condições apropriadas para este fim, diversos processos físicos e químicos são conduzidos desde sua captação - em rios, lagos, etc - até sua entrada na rede de distribuição. Numa estação de tratamento de água (ETA), ocorrem as seguintes etapas:
I - Coagulação - a água captada e bombeada em sua forma bruta é tratada com hidróxido e sulfato de alumínio para aglomerar alguns eventuais tipos de partículas sólidas.
II - Floculação e decantação - os aglomerados de partículas sólidas aumentam de tamanho com a movimentação da água e depositam-se no fundo de tanques, separando-se da água.
III- Filtração - a água proveniente dos tanques de decantação é filtrada de forma a remover impurezas menores que as anteriormente removidas.
IV - Desinfecção - hipoclorito de sódio ou ozônio são aplicadas na água para eliminar microrganismos patogênicos.
V - Fluoretação - é aplicado fluoreto de sódio (ou de cálcio) na água para auxiliar na manutenção da saúde dentária.
VI - Correção de pH - carbonato de sódio é adicionado à água para ajustar sua acidez e impedir a deterioração da rede de distribuição.
Assinale a opção que apresenta as fórmulas que representam as substâncias mencionadas nas etapas I, IV, V e VI, respectivamente.
O pentacloroetano foi durante algum tempo utilizado para limpeza a seco e solvente para resinas e borrachas. Por causa de seu impacto ambiental, o pentacloroetano não é vendido ou importado em muitos países. Este composto pode reagir com o fluoreto de hidrogênio de acordo com a seguinte equação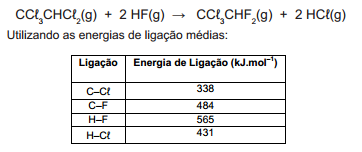
A variação de entalpia da reação apresentada, em kJ.mol-1, é
igual a:
O ácido acético, também designado ácido etanoico, é um ácido fraco, monocarboxílico, alifático. Esse ácido apresenta um odor picante e encontra-se em muitos produtos de origem animal e vegetal, sendo o componente essencial do vinagre de mesa. Uma solução de ácido acético foi preparada com concentração de 6 g.L-1. O valor da concentração do íon acetato, em mol.L1, nessa solução considerando o pKa do ácido acético igual a 5,0, é:
Rochas contendo silicatos alcalinos podem reagir com o dióxido de carbono com a fi nalidade de produzir carbonatos sólidos insolúveis que poderiam ser enterrados no solo, minimizando a disponibilidade desse gás no ambiente e do ácido carbônico nos oceanos. Um método indireto pode utilizar as reações:
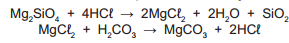
Nesse processo, a quantidade de silicato de magnésio (em toneladas) necessária para reagir completamente com 6,2 toneladas de ácido carbônico é igual a:
A lei de velocidade de uma reação de decaimento nuclear corresponde a uma equação diferencial que relaciona a variação das concentrações das espécies com o tempo. Considerando uma reação de primeira ordem, a fração que decaiu da espécie radioativa após um período de três meias-vidas é:
A cocaína é um alcaloide de fórmula geral C17H21NO4, que foi isolado das folhas de coca em 1860. Alguns traficantes misturam na cocaína bicarbonato de sódio para aumentar seus lucros, tornando o produto ainda mais letal que é o CRACK. Baseado nos dados acima é correto afirmar que:

Considere as assertivas abaixo, que se referem a questões de equilíbrio químico:
Assinale a alternativa com as assertivas VERDADEIRAS:


