Uma forma de obter a energia necessária para o futuro é
encontrar maneiras efetivas de gerar eletricidade a partir das
reações químicas. Fontes de eletricidade portáteis, mas
eficientes, são necessárias para equipamentos pequenos, de
corações artificiais e computadores de bolso até automóveis
elétricos e habitações espaciais. Sendo assim, um dos ramos da
eletroquímica é o uso de reações químicas espontâneas para
produzir eletricidade.
(ATKINS, P. e JONES, L. Princípios de Química: questionando a vida moderna e o
meio ambiente. Porto Alegre: Bookman, 2001. p. 603. Adaptado)
Uma das formas de prever a espontaneidade de um processo
eletroquímico é por meio da análise dos potenciais−padrão de
redução.
Considere a tabela de potenciais a seguir.
A equação global que descreve o processo espontâneo, com
maior geração de energia, é dada por:
A viabilidade de qualquer forma de geração de energia não depende apenas dos custos de produção ou potencial energético, mas também do impacto ambiental causado pela sua obtenção. Uma possível alternativa para esse caso é o modelo de bateria de metal/ar.
A bateria Al/O2, por exemplo, pode atingir centenas de metros imerso na água do mar alimentando dispositivos e instrumentos durante vários meses.
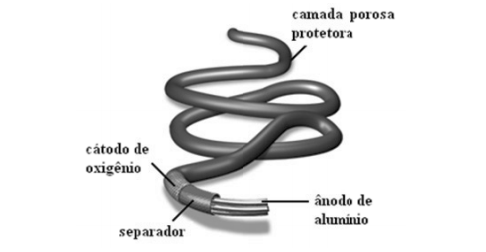
Sobre o funcionamento da bateria esquematizada na figura acima, assinale a afirmativa correta.
O professor preparou quatro experimentos para demonstrar
aos alunos os fatores que afetam as velocidades das reações.
Nestes experimentos o professor utilizou óxido de magnésio na
presença de quantidades iguais de água e do indicador
fenolftaleína.
As condições dos experimentos eram as seguintes:
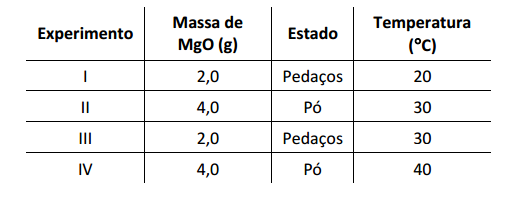
Os resultados permitiram avaliar as velocidades das reações através da mudança de coloração da solução.
Assinale a alternativa que indica a ordem de aparecimento da cor nos experimentos.
Alguns hidrocarbonetos aromáticos são essenciais para a síntese de um grande número de substâncias de importância econômica. Estes compostos são obtidos industrialmente por meio da Reforma Catalítica de determinadas frações de petróleo. Os hidrocarbonetos aromáticos são separados dos alifáticos por um processo de extração seletiva e, em seguida, purificados.
A tabela a seguir relaciona os hidrocarbonetos aromáticos produzidos através desse processo e as suas temperaturas de fusão e de ebulição.

Sobre a separação e purificação dos hidrocarbonetos aromáticos produzidos através da Reforma Catalítica, assinale a afirmativa correta.
O correto armazenamento dos reagentes utilizados em um laboratório de química é fundamental para garantir a segurança do professor e dos alunos. A organização dos reagentes deve sempre levar em conta o grau de risco representado por cada um deles, além da sua reatividade.
Um laboratório recém−inaugurado conta com os reagentes relacionados na lista a seguir, que devem ser organizados em armários diferentes.
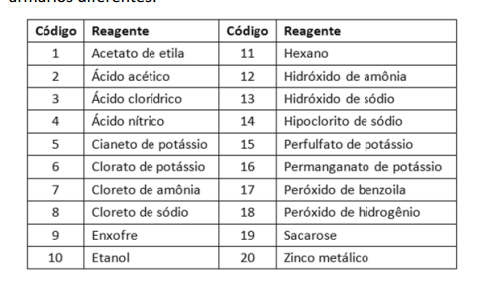
Assinale a alternativa que indica os códigos dos reagentes que deverão ser colocados em um mesmo armário.
Os equilíbrios químicos explicam grande número de fenômenos
naturais e têm papéis importantes em muitos processos
industriais. A constante de equilíbrio permite avaliar se a
reação é favorável aos produtos ou aos reagentes.
A tabela a seguir apresenta os valores das constantes de
equilíbrio em função das concentrações molares, calculadas a
500K, de alguns sistemas.

Em relação aos dados fornecidos na tabela, assinale a afirmativa correta. maior que o produto das concentrações dos reagentes.
Qual é a opção que define INCORRETAMENTE a propriedade da matéria apresentada?
Uma das etapas da produção de ácido sulfúrico é a formação de trióxido de enxofre gasoso através da reação de dióxido de enxofre gasoso com gás oxigênio, na presença de um catalisador de óxido de vanádio.
Considere a ocorrência dessa reação em um sistema no qual o equilíbrio será alcançado. Segundo o princípio de Le Chatelier, um fator que pode deslocar esse equilíbrio no sentido da diminuição da concentração de dióxido de enxofre é:
Estudos relacionados ao azeite de oliva indicam que ele não é bom apenas para a saúde do coração. É ainda fonte das vitaminas A, K e E, e também dos elementos ferro, cálcio, magnésio, potássio. Portanto o azeite faz bem para a pele, olhos, ossos e para o sistema imunológico. Relacionando as posições dos elementos citados na classifi cação periódica com suas propriedades, é correto afi rmar que:
Diversos álcoois alifáticos têm sido observados na atmosfera atuando como poluentes. O álcool das folhas, como é chamado o hex-3-en-1-ol, é uma substância liberada pela grama, pelas árvores e lavouras. Esse composto reage com o ozônio atmosférico, produzindo substâncias poluentes que possuem a função orgânica:
Em 1827, o químico alemão Friedrich Wöhler finalmente conseguiu, com suprema engenhosidade experimental, isolar o alumínio metálico. Basicamente, o experimento de Wöhler envolveu o aquecimento de cloreto de alumínio desidratado com potássio puro hiper-reativo, que removeu o cloreto do alumínio.
(STRATHERN, P. O sonho de Mendeleiev, 1ª edição. Rio de Janeiro, RJ: Jorge Zahar Editor, 2002, p.219.)
Na reação realizada por Wöhler ocorreu uma:
O boro-hidreto é um agente redutor útil, pois a semirreação
esquematizada a seguir, apresenta baixo potencial de redução:
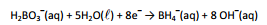
O íon boro-hidreto pode ser utilizado na deposição de níquel a
partir de uma solução contendo Ni2+.
A reação entre o íon boro-hidreto e o Ni2+ ocorre
A Lei de Efusão de Gases, escrita por Graham em 1846, afirma:
“a velocidade de efusão de um gás é inversamente proporcional à
raiz quadrada de sua densidade,ou de seu peso molecular."
A velocidade de um gás hipotético X2, através de um orifício,
corresponde a 0,315 vezes à velocidade do gás hidrogênio (H2),
formado apenas por isótopos de número de massa 1,0 através do
mesmo orifício nas mesmas condições de temperatura e pressão.
O valor do número de massa de X determinado pela Lei de
Graham é aproximadamente:
Dado: √ = 1,414
Para o preparo em laboratório de uma solução 4% (massa/volume) de hidróxido de sódio a partir de 50 mL de uma solução 5 mol . L-1
dessa base, é necessário Dados: Massa molar (g.mor-1): Na = 23 0 = 16 H = 1
Um químico preparou, para neutralizar o rejeito de uma reação,
uma solução básica de hidróxido de sódio dissolvendo óxido de
sódio puro em água, em um balão volumétrico de 250 mL. Uma
alíquota de 25 mL desta solução foi transferida para outro balão
volumétrico e diluída com água até 500 mL. A solução resultante
apresentou pH igual a 13.
No preparo da solução básica, a massa de óxido de sódio (em
gramas) dissolvida foi igual a
Dados: Massa molar (g.mol–1): H = 1 O = 16 Na = 23

