As etapas de tratamento da água de um município, que
apresenta dureza elevada, estão relacionadas a seguir.
I.Aeração e remoção de solutos voláteis;
II.Adição de óxido de cálcio;
III.Decantação em decantador primário;
IV.Coagulação com a adição de sulfato de ferro (III) e sulfato de
alumínio;
V.Cloração e filtração.
De acordo com essas etapas, o sulfeto de hidrogênio, o metano e
o metanotiol são retirados na etapa:
Um químico analisou uma amostra pura de um monoálcool
saturado que apresentou temperatura de ebulição 118C, massa
molar igual a 74 g.mol–1 e reagiu com dicromato de potássio em
meio ácido produzindo um ácido carboxílico. O espectro de
massas deste composto apresentou o pico do íon molecular
pouco intenso, os picos de maiores abundâncias relativas
apresentaram m/z em 56, 43, 41 e 31. Não foram observados
picos em m/z 59 e m/z 15.
O álcool presente na amostra é o
Dados: Massa molares (g.mol–1) H = 1 C = 12 O = 16
O dióxido de enxofre é um gás utilizado na produção do ácido
sulfúrico. Esse gás é emitido na queima de combustíveis e pode
ser muito prejudicial à saúde e ao meio ambiente. Para analisar a
presença de dióxido de enxofre em um determinado local, uma
amostra de ar foi borbulhada em 500 mL de um meio que
promoveu a conversão total do dióxido de enxofre em sulfato.
A amostra resultante foi analisada em um cromatógrafo iônico
em condições apropriadas, na mesma temperatura,
demonstrando que a concentração de sulfato presente
corresponde a 1 mmol . L–1.
A massa (em mg) de dióxido de enxofre presente na amostra é:
Dados: Massa molares (g.mol–1) S = 32 e O = 16
Os carboidratos ocupam uma posição importante na química do processo vital. Estes
compostos são formados nas plantas, a partir da fotossíntese, e constituem o principal produto
do processo pelo qual as moléculas inorgânicas e a energia solar são incorporadas aos seres
vivos. Os carboidratos são polihidroxialdeídos ou cetonas de fórmula empírica CnH2nOn.
Considere n = 6, NA sendo a constante de Avogadro e, nas questões a seguir julgue os itens
(V ) se forem verdadeiros, ou (F ) se forem falsos:
I. ( ) Uma solução aquosa de CnH2nOn 0,5 mol L-1 tem 90 g de glicose em 1L de solução.
II. ( ) 1 mmol de CnH2nOn tem uma massa de 180 mg.
III. ( ) 0,0100 mol de CnH2nOn tem 0,0100 x 24 x NA átomos.
IV. ( ) Em 90,0 g de CnH2nOn há 3 x NA átomos de carbono.
V. ( ) Em 100 mL de uma solução 0,10 mol L-1 há 18 g de CnH2nOn.
Assinale a alternativa CORRETA:
Numere a segunda coluna de acordo com a primeira, considerando as reações químicas
hipotéticas a seguir:
A sequência correta é:
O efeito Joule-Thomson é usado para liquefazer gases, desde que se construa um sistema em que o gás é repetidamente comprimido e expandido, diminuindo sua temperatura até que ela chegue a um valor tão baixo, que o gás se condense formando o líquido. Se o coeficiente de Joule-Thomson para o gás nitrogênio, N2(g), é 0,1173 K atm-1, a temperatura final do nitrogênio a 20 atm e 100 0C, que é forçado através de uma barreira até uma pressão final de 1 atm é:
Por vários motivos, o hidrogênio – queimado ou utilizado em células de combustível – é uma opção atraente para abastecer os automóveis do futuro. Diversas matérias-primas e fontes de energia (renovável, nuclear ou fóssil) podem ser utilizadas para produzi-lo. Além disso, o hidrogênio e o produto de sua combustão, a água, não são tóxicos e não poluem. Não há liberação de dióxido de carbono, um potente gás responsável pelo efeito estufa. A eficiência dos veículos movidos a célula de combustível é até duas vezes maior que a dos veículos atuais. O hidrogênio poderia, assim, ajudar a reduzir urgentes problemas sociais e ambientais, como a poluição do ar e seus riscos à saúde, a mudança climática global e a dependência da importação de petróleo estrangeiro (http://www2.uol.com.br/sciam/reportagens/abastecendo_com_hidrogenio.html, 29/01/2013). Em um laboratório de química do Instituto Federal de Alagoas, a 20 °C e utilizando um sistema adequado, foi misturado uma liga de 0,5 g de magnésio e 500 cm3 de solução aquosa de HCl0,5 mol L1. Um manômetro indicou que a pressão no interior do recipiente que contém o H2(g) era de 756,7 mmHg. Sabendo-se que a pressão de vapor-d’água a 20 oC é 17,54 mmHg e o volume de H2(g) obtido foi 0,500 L, determine a pureza aproximada da amostra da liga de magnésio (massa de magnésio x 100/massa total da amostr(A), considerando que somente o magnésio reaja com o HCl.
Durante a análise de uma amostra de água, um técnico observou a presença dos seguintes sais: cloreto plumboso, bicarbonato de cálcio, nitrato de sódio e sulfato de estrôncio. Assinale a alternativa que apresenta a fórmula CORRETA de cada um dos sais citados:
“É um dispositivo amplamente usado em laboratórios científicos para aquecer substâncias. É utilizado na esterilização de pequenos objetos, para aquecer produtos químicos, polir a fogo vidros quebrados e para muitas outras finalidades. Basicamente ele é um queimador de gás de pequeno porte com uma chama ajustável, onde se pode manipular a quantidade de gás e ar.” Assinale a alternativa que explicita o equipamento referido no texto, utilizado no laboratório de química.
Assinale a alternativa que explicita a denominação do processo de separação de duas ou mais substâncias sólidas, usando um líquido que dissolva apenas uma das substâncias em questão:
Um adubo químico utilizado nas lavouras de café é
composto de Nitrogênio, Fósforo e Potássio. No solo, os
íons potássio são absorvidos pelas plantas. Após a
colheita, as cascas são queimadas em fornalhas, onde o
potássio reaparece como óxido de potássio.
Dados: K+1 e O-2
A sequência que representa, respectivamente, os
símbolos das palavras em negrito no texto são
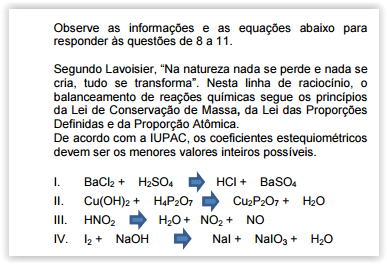
Faça o balanceamento das reações e, em seguida, assinale a alternativa que apresenta a soma dos coeficientes da reação IV.
As funções inorgânicas são um conjunto de substâncias
que reúne todos os elementos químicos que formam os
ácidos, bases, sais e óxidos. As principais funções
químicas inorgânicas são encontradas em nosso cotidiano
e também em nosso organismo.
Observe o conjunto de substâncias inorgânicas abaixo e,
em seguida, assinale a alternativa que apresenta suas
classificações, respectivamente, conforme sua função
química.
NaCl, H2CO3, Fe2O3, NaOH, H2SO4
Leia o trecho abaixo e, em seguida, assinale a alternativa
que preenche correta e respectivamente as lacunas.
Avaliando a Tabela Periódica, um elemento químico é
representado pelo seu ___________ e identificado pelo
número de __________.
Chuva ácida refere-se à deposição úmida de constituintes
ácidos presentes na atmosfera, os quais se dissolvem nas
nuvens e nas gotas de chuva para formar uma solução
com pH inferior a 5,6 . Deste modo, analise as afirmações
abaixo.
I. A chuva ácida pode ter causas naturais, pois em
algumas regiões localizadas, a chuva pode ser
acidificada por emissões naturais provenientes da
atividade de vulcões, da queima de biomassa e
através de processos metabólicos em algas,
fitoplâncton e em algumas plantas presentes em
ambientes marinhos, costeiros e continentais.
II. A chuva ácida sempre cai onde foi gerada. Como é
desprezível a ação do vento, desaba próxima a fonte
poluidora. As enormes chaminés, com as quais se
pretendia evitar a poluição, contribuem para que isso
aconteça.
III. Uma represa ou um lago acidificado parece limpo e
cristalino, mas não contém vida. Os seres vivos são
afetados não só pela acidez da água em si, que
interfere em seus processos fisiológicos, mas
também pela solubilização e mobilização de metais
tóxicos à vida aquática. Em geral, à medida que o
pH da água se aproxima de 6,0, algumas espécies
de crustáceos, insetos e plânctons começam a
desaparecer.
É correto o que se afirma em