Avalie as afrmações que seguem com base no tema “plásticos e polímeros” atribuindo respectivamente V (verdadeiro) ou F (falso) e assinale a alternativa que apresenta a sequência correta de cima para baixo. ( ) Os polímeros podem ser de origem natural ou sintética. ( ) Plástico é um material macromolecular que pode-se tornar fuído e moldável. ( ) Os polímeros podem ser divididos em três grandes grupos: borrachas, plásticos e fbras.
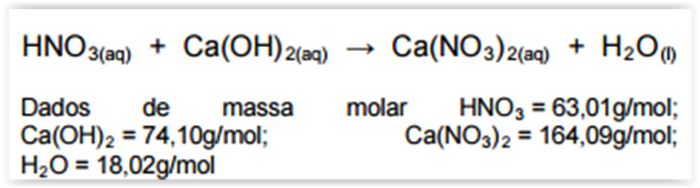
Considerando-se a reação de neutralização total não
balanceada a seguir, assinalar a alternativa CORRETA:
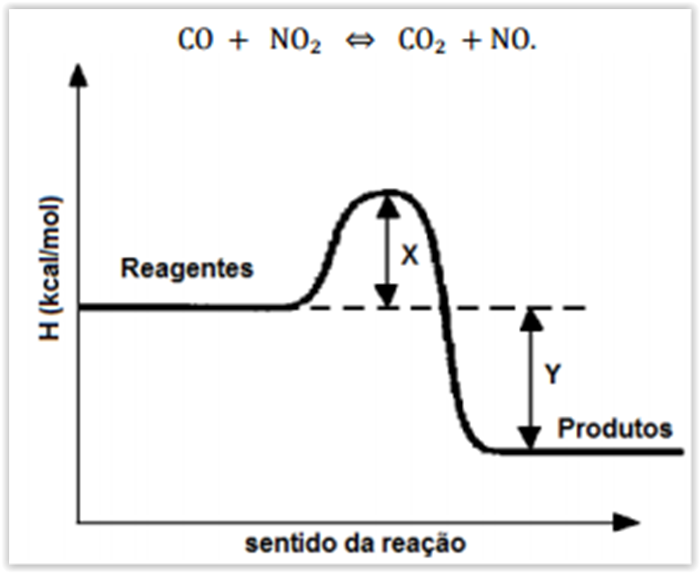
O gráfico abaixo representa a variação de energia potencial quando ocorre a oxidação do monóxido de carbono,
pela ação do dióxido de nitrogênio, segundo a reação química:
Quanto à situação descrita, analisar os itens abaixo:
I - Na reação direta, X representa a energia de ativação da reação.
II - Na reação direta, Y representa a energia absorvida pela reação.
III - A reação indireta é endotérmica.
Está(ão) CORRETO(S):
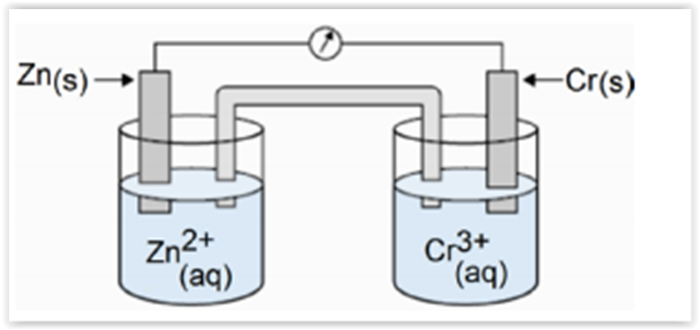
Uma pilha é definida como um equipamento que consegue converter energia química em energia elétrica. Para isso,
ela precisa conter dois eletrodos, o cátodo e o ânodo, formados por diferentes metais, por onde os elétrons irão fluir,
gerando a corrente elétrica. Diante do exposto, considerar a pilha galvânica apresentada na figura abaixo:
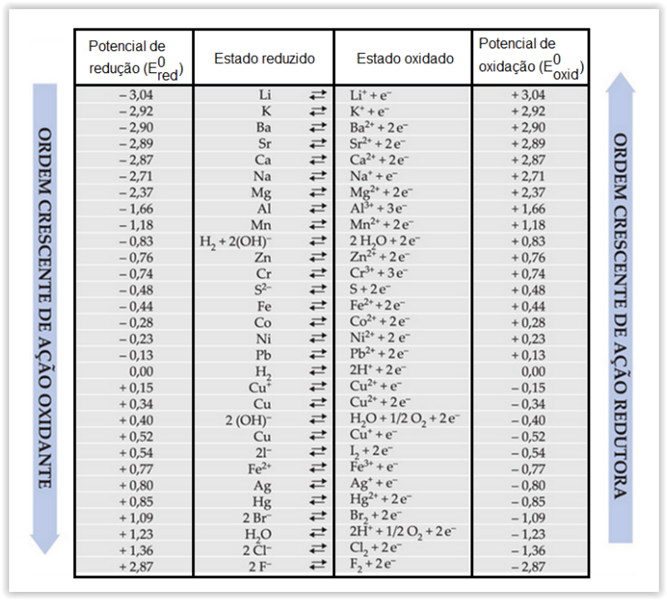
Considerando-se também a tabela de potenciais-padrão de redução, apresentados na tabela abaixo em V, assinalar a
alternativa que apresenta a força eletromotriz desse sistema em mV:
Com relação aos instrumentos de laboratório para medidas precisas de volume, assinalar a alternativa CORRETA:
Alguns pr°Cessos de obtenção de H2SO4 utilizam pirita (FeS2) como matérIa-prima no lugar de enxofre elementar (S8).
Esses pr°Cessos podem ser descritos resumidamente pelas seguintes equações, nas quais se pode notar varIações no
estado de oxidação do enxofre:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
De acordo com o texto, assinale a alternativa que apresenta os estados de oxidação do enxofre nas espécies FeS2, SO2,
SO3 e H2SO4, respectivamente.
A queima de enxofre elementar gera compostos gasosos responsáveis pela formação da chuva ácida, com consequente
deterioração de edificações e de monumentos construídos em mármore, acompanhada de liberação de gás carbônico na
atmosfera. Esse pr°Cesso pode ser ilustrado pelas seguintes reações não balanceadas:
S + O2 → SO2
SO2 + O2 → SO3
SO3 + H2O → H2SO4
H2SO4 + CaCO3 → CaSO4 + H2CO3
H2CO3 → CO2 + H2O
Considerando essa sequêncIa de eventos, assinale a alternativa que apresenta a equação global balanceada dos eventos
supracitados.
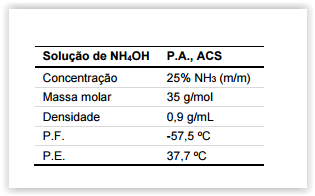
Foi requisitado a um técnico de laboratório que preparasse uma
solução de hidróxido de amônio, a partir de uma solução comercIal
concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
Assinale a alternativa que indica o volume aproximado da solução
comercIal (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
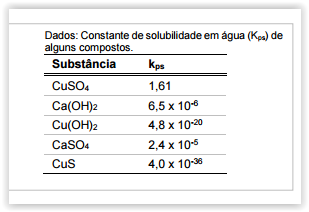
A calda bordalesa, muito utilizada como fungicida na agricultura, é
preparada pela mistura de sulfato de cobre pentaidratado
(CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em
proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma
suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a
alternativa que apresenta o constituinte principal do sólido suspenso
na calda bordalesa.
Assinale a alternativa que apresenta um exemplo de fenômeno químico.
A substância cujas moléculas são formadas exclusivamente por li gações covalentes é apresentada na alternativa:
Considere a seguinte situação:
Uma solução apresenta pH=9,0.
O reagente indicado para se ajustar o pH dessa solução a pH=7,0 está apresentado na alternativa:
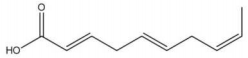
A esteroquímica das ligações duplas nas posições 2, 5 e 8 do composto cuja estrutura é representada a seguir apresentam, respectiva mente, as configurações:
Em um laboratório de química analisou-se uma substância orgânica e determinou-se sua composição percentual como segue: C (40,9%), H (4,6%) e O (54,5%). A fórmula mínima da substância é:
Considere a equação de equilíbrio a seguir:

Sabe-se que os valores de entalpia padrão de formação (ΔH°f ), em kJ mol -1 à 25 °C são: NH3 = -46, N2 e H2 = 0.
Se a temperatura desse sistema em equilíbrio for aumentada, o equilíbrio será deslocado no sentido de aumentar a concentração