As propriedades físicas e químicas de uma certa substância estão relacionadas as interações entre as unidades que a constituem, isto é, as ligações químicas entre átomos ou íons e as forças intermoleculares que a compõem. No quadro, estão relacionadas algumas propriedades de cinco substâncias.

Qual substância apresenta propriedades que caracterizam o cloreto de sódio (NaCI)?
Uma das possíveis alternativas para a substituição da gasolina como combustível de automóveis é a utilização do gás hidrogênio, que, ao reagir
com o gás oxigênio, em condições adequadas, libera energia necessária para o funcionamento do motor, conforme a equação química a seguir:
2 H2 (g) + 02 (g) —> 2 H2O (g) + energia
Esta opção para a substituição da gasolina contribuiria para que a condição do meio ambiente seja melhorada,
visto que O
Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia que seja uma protease gástrica, que age no estômago digerindo proteínas. Sabendo que a digestão no estômago é acida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém:
Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3(s) + SO2 (g) à CaSO3 (s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa e de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 Ca SO3 (s) + O2 (g) à 2 CaSO4 (s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cáclcio são iguais a 12g/mol, 16g/mol, 32g/mol e 40g/mol, respectivamente.
BAIRD, C. Química Ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
O biodiesel não é classificado como uma substância pura, mas como uma mistura de ésteres derivados dos ácidos graxos presentes em sua matéria-prima. As propriedades do biodiesel variam com a composição do óleo vegetal ou gordura animal que lhe deu origem, por exemplo, o teor de ésteres saturados é responsável pela maior estabilidade do biodiesel frente à oxidação, o que resulta em aumento da vida útil do biocombustível. O quadro ilustra o teor médio de ácidos graxos de algumas fontes oleaginosas.
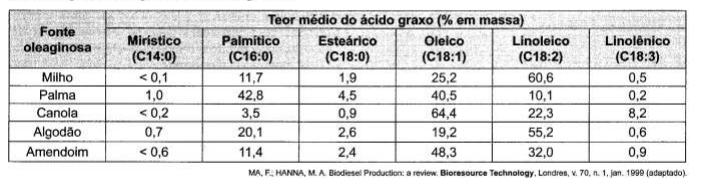
Qual das fontes oleaginosas apresentadas produziria um biodiesel de maior resistência à oxidação?
A utilização de processos de birremediação de resíduos gerados pela combustão incompleta de compostos orgânicos tem se tornado crescente, visando minimizar a poluição ambiental. Para ocorrência de resíduos de naftaleno, algumas legislações limitam sua concentração em até 30mg/Kg para solo agrícola e 0,14mg/L para água subterrânea. A quantificação desse resíduo foi realizada em diferentes ambientes, utilizando-se amostras de 500 g de solo e 100 mL de água, conforme apresentado no quadro.
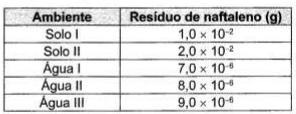
O ambiente que necessita de biorremediação é o(a)
Para impedir a contaminação microbiana do suprimento de água, deve-se eliminar as emissões de efluentes e, quando necessário, tratá-lo com desinfetante. O ácido hipocloroso (HCIO), produzido pela reação entre cloro e água, é um dos compostos mais empregados como desinfetante. Contudo, ele não atua somente como oxidante, mas também como um ativo agente de cloração. A presença de matéria orgânica dissolvida no suprimento de água clorada pode levar à formação de clorofórmio (CHCI3) e outras espécies orgânicas cloradas tóxicas.
SPIRO, T. G., STIGLIANI, W. M. Química ambiental São Paulo: Pearson, 2009 (adaptado).
Visando eliminar da água o clorofórmio e outras moléculas orgânicas, o tratamento adequado é a
Os bafõmetros (etilõmetros) indicam a quantidade de álcool, C2H60 (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:

Na reação global de funcionamento do bafõmetro, os reagentes e os produtos desse tipo de célula são
Em um experimento, foram separados três recipientes A, B e C, contendo 200 mL de líquidos distintos: o recipiente A continha água, com densidade de 1,00 g/mL; o recipiente B, álcool etílico, com densidade de 0,79 g/mL; e o recipiente C, clorofórmio, com densidade de 1,48 g/mL. Em cada um desses recipientes foi adicionada uma pedra de gelo, com densidade próxima a 0,90 g/mL. No experimento apresentado, observou-se que a pedra de gelo
A elevada acidez dos solos é um dos fatores responsáveis por reduzir sua capacidade de troca de cations, intensificando a perda de sais minerais
por arraste. Como consequência, os solos ficam deficientes em nutrientes e com baixo potencial produtivo. Uma estratégia usada no controle dessa
acidez a aplicar 6xidos capazes de formar bases pouco solúveis em meio aquoso. Inicialmente, para uma determinada aplicação, são apresentados os
seguintes Óxidos: NO, CO2, SO2, CaO e Na20. Para essa aplicação, o Oxido adequado para minimizar o efeito de arraste e o
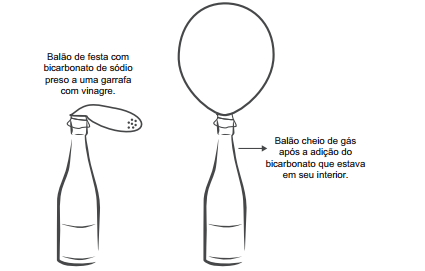
A transformação química em questão é representada pela equação:
Após o desmonte da bateria automotiva, é obtida
uma pasta residual de 6 kg, em que 19%, em massa,
é dióxido de chumbo(IV), 60%, sulfato de chumbo(II) e
21%, chumbo metálico. O processo pirometalúrgico é o
mais comum na obtenção do chumbo metálico, porém,
devido à alta concentração de sulfato de chumbo(II),
ocorre grande produção de dióxido de enxofre (SO2),
causador de problemas ambientais. Para eliminar a
produção de dióxido de enxofre, utiliza–se o processo
hidrometalúrgico, constituído de três etapas, no qual o
sulfato de chumbo(II) reage com carbonato de sódio a
1,0 mol/L a 45 °C, obtendo–se um sal insolúvel (etapa 1),
que, tratado com ácido nítrico, produz um sal de chumbo
solúvel (etapa 2) e, por eletrólise, obtém–se o chumbo
metálico com alto grau de pureza (etapa 3).
ARAÚJO, R. V. V. et al. Reciclagem de chumbo de bateria automotiva: estudo de caso.
Disponível em: www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado).
Considerando a obtenção de chumbo metálico a
partir de sulfato de chumbo(II) na pasta residual, pelo
processo hidrometalúrgico, as etapas 1, 2 e 3 objetivam,
respectivamente,
O brasileiro consome em média 500 miligramas de cálcio por dia, quando a quantidade recomendada é o dobro. Uma alimentação balanceada é a melhor decisão para evitar problemas no futuro, como o osteoporose, uma doença que atinge os osso. Ela se caracteriza pela diminuição substancial de massa óssea, tornando os ossos frágeis e mais suscetíveis a fraturas.
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 212 (adaptado).
Considerando-se o valor de 6 x 1023 mol-1 para o constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?
Entre as substâncias usadas para o tratamento de água está o sulfato de alumínio que, em meio alcalino, forma partículas em suspensão na água, às quais as impurezas presentes no meio se aderem.
O método de separação comumente usado para retirar o sulfato de alumínio com as impurezas aderidas é a
A varfarina é um fármaco que diminui a agregação plaquetária, e por isso é utilizada como anticoagulante, desde que esteja presente no plasma, com uma concentração superior a 1,0 mg/L. Entretanto concentrações plasmáticas superiores a 4,0 mg/L podem desencadear hemorragias. As moléculas desse fármaco ficam retidas no espaço intravascular e dissolvidas exclusivamente no plasma, que representa aproximadamente 60% do sangue em volume. Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um individuo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que pode ser administrado a esse individuo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?

