A gasolina é uma mistura de hidrocarbonetos de cadeias saturadas contendo de 8 a 12 átomos de carbono. Além disso, a gasolina de alto desempenho deve conter elevados teores de hidrocarbonetos de cadeias ramificadas, de forma a resistir à compressão e entrar em ignição apenas quando a vela aciona uma centelha elétrica no motor. No quadro, estão apresentados compostos que podem ser utilizados como combustíveis.
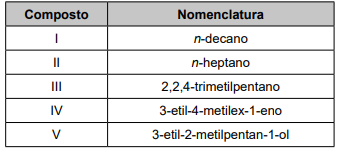
Entre esses compostos, aquele que conferirá maior desempenho como combustível é o
O grande risco envolvido no emprego indiscriminado dessa substância deve-se à sua ação química como
O mármore, rocha metamórfica composta principalmente de carbonato de cálcio (CaCO3), é muito utilizada como material de construção e também na produção de esculturas. Entretanto, se peças de mármore são expostas a ambientes externos, particularmente em grandes cidades e zonas industriais, elas sofrem ao longo do tempo um processo de desgaste, caracterizado pela perda de massa da peça.
Esse processo de deterioração ocorre em função da
O alerta dado por Levi justifica-se porque a
Nos anos 1990, verificou-se que o rio Potomac,
situado no estado norte-americano de Maryland, tinha,
em parte de seu curso, águas extremamente ácidas por
receber um efluente de uma mina de carvão desativada, o
qual continha ácido sulfúrico (H2SO4). Essa água, embora
límpida, era desprovida de vida. Alguns quilômetros
adiante, instalou-se uma fábrica de papel e celulose
que emprega hidróxido de sódio (NaOH) e carbonato de
sódio (Na2CO3) em seus processos. Em pouco tempo,
observou-se que, a partir do ponto em que a fábrica lança
seus rejeitos no rio, a vida aquática voltou a florescer
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro:
Livros Técnicos e Científicos. 2012 (adaptado)
A explicação para o retorno da vida aquática nesse rio é a
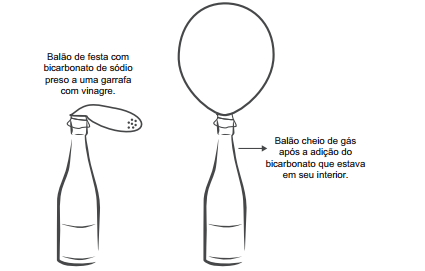
Em um experimento, colocou-se água até a metade
da capacidade de um frasco de vidro e, em seguida,
adicionaram-se três gotas de solução alcoólica de
fenolftaleína. Adicionou-se bicarbonato de sódio
comercial, em pequenas quantidades, até que a solução
se tornasse rosa. Dentro do frasco, acendeu-se um
palito de fósforo, o qual foi apagado assim que a
cabeça terminou de queimar. Imediatamente, o frasco
foi tampado. Em seguida, agitou-se o frasco tampado e
observou-se o desaparecimento da cor rosa.
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que,
com a combustão do palito de fósforo, ocorreu o(a)
A soda cáustica pode ser usada no desentupimento
de encanamentos domésticos e tem, em sua composição,
o hidróxido de sódio como principal componente, além de
algumas impurezas. A soda normalmente é comercializada
na forma sólida, mas que apresenta aspecto "derretido"
quando exposta ao ar por certo período.
O fenômeno de “derretimento" decorre da
A elevada acidez dos solos é um dos fatores responsáveis por reduzir sua capacidade de troca de cations, intensificando a perda de sais minerais
por arraste. Como consequência, os solos ficam deficientes em nutrientes e com baixo potencial produtivo. Uma estratégia usada no controle dessa
acidez a aplicar 6xidos capazes de formar bases pouco solúveis em meio aquoso. Inicialmente, para uma determinada aplicação, são apresentados os
seguintes Óxidos: NO, CO2, SO2, CaO e Na20. Para essa aplicação, o Oxido adequado para minimizar o efeito de arraste e o
A transformação química em questão é representada pela equação:
Devido ao seu alto teor de sais, a água do mar é
imprópria para o consumo humano e para a maioria
dos usos da água doce. No entanto, para a indústria,
a água do mar é de grande interesse, uma vez que
os sais presentes podem servir de matérias–primas
importantes para diversos processos. Nesse contexto,
devido a sua simplicidade e ao seu baixo potencial de
impacto ambiental, o método da precipitação fracionada
tem sido utilizado para a obtenção dos sais presentes
na água do mar.
Tabela 1: Solubilidade em água de alguns compostos
presentes na água do mar a 25ºC
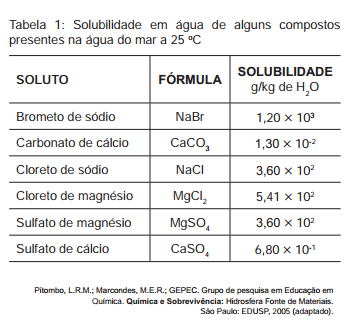
Suponha que uma indústria objetiva separar
determinados sais de uma amostra de água do mar a
25 ºC, por meio da precipitação fracionada. Se essa
amostra contiver somente os sais destacados na tabela,
a seguinte ordem de precipitação será verificada:



