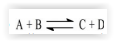Fertilizantes nitrogenados sólidos são essenciais na produção de alimentos em quantidade suficientes para atender à crescente expansão populacional. A matéria-prima para a obtenção desses produtos é a amônia gasosa. Sua solução aquosa reage com ácido sulfúrico para formar o fertilizante sulfato de amônio. Assinale a alternativa que represente as transformações citadas por meio de equações químicas.
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
Que quantidade de glicose é necessária para preparar uma solução a 10% a partir de uma solução de 500 mL de glicose a 5%?
Em uma aula prática, 10 adições de 0,02 mL de uma solução 0,37 mol l-1 de sacarose são feitas em um balão volumétrico de 5 mL contendo 1 mL de água destilada. Após essas adições, a concentração de sacarose no balão, em mol l-1, será de:
Visando determinar o teor de umidade de uma amostra de solo contaminado, um perito recolheu 4,860g de amostra previamente homogeneizada para uma cápsula de porcelana de massa igual a 22,148g. Após 6 horas de secagem em estufa a 110°C, seguida de resfriamento em dessecador até temperatura ambiente, a cápsula contendo a amostra de solo apresentou massa igual a 25,451g. Assinale a alternativa que contém a porcentagem de umidade na amostra de solo analisada.
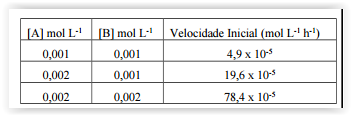
A equação
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
Considere uma pessoa adulta, em repouso, com um gasto
energético de 2000 kcal e consumo de 2500 kcal em um dia, na
forma de alimentos. Suponha, também, que 70% do seu peso
corporal de 80 kg vem da água que constitui seu corpo. Calcule
a energia, em kcal, que o corpo humano teria em excesso se,
além do repouso, a temperatura da água corporal aumentasse
de 36,5 para 38 oC:
Considere que 1 cal equivale à energia
necessária para elevar de 1 °C a temperatura
de 1 g de água
Um analista precisa preparar uma solução aquosa de 1000 mg l-1 de Th(NO3)4. No almoxarifado, ele tem à sua disposição um frasco contendo Th(NO3)4.5H2O, com indicação de 80% de pureza. Qual é a massa de sal, em gramas, necessária para preparar 1 litro da solução Th(NO3)4?
Na determinação de cálcio em águas naturais, a AOAC (Ass°CIation of OfficIal Analytical Chemists/USA) recomenda um
método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e,
em seguida, adicionar a quantidade necessárIa de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a
massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser
expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma
amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4-2(aq.) → CaC2O4(s)CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol;
densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
A análise elementar de um composto orgânico resultou em 48,63% de carbono, 43,19% de oxigênio e 8,18% de H. Sabendo-se que o peso molecular desse composto é 222,3 g mol-1, sua fórmula molecular é:
O metano é um dos subprodutos dos aterros sanitários, produzido pela decomposição anaeróbica de resíduos orgânicos. Os produtos de sua combustão são C02 e H2O. Quantos mols de vapor de água podem ser produzidos por 4,0 g de metano?
Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:Considere que a massa do próton é igual à massa do nêutron e vale 1,7 x 10-27 kg.
Um pilar de extremidades articuladas tem seção transversal quadrada de 2m de comprimento. Esta coluna é constituída de pinho com E = 13GPa e σadm = 12 Mpa para compressão na direção paralela às fibras. Usando um coeficiente de segurança de 2,5 no cálculo da carga crítica de Euler para flambagem, determinar a dimensão, em mm, da seção transversal, de modo que a coluna possa resistir com segurança a uma força de 100KN.
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
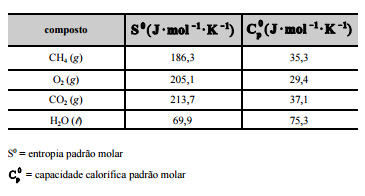
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.
A água mineral e os refrigerantes gaseificados contêm o gás carbônico, que reage com a água, produzindo um meio ácido. O gás carbônico é mais solúvel em água quando submetido a altas pressões. Por esse motivo, se for deixada uma garrafa de refrigerante aberta, parte do gás carbônico escapa, tornando o refrigerante “choco”, ou seja, menos ácido. Esse gás citado também é produzido, quando material rico em carbono entra em combustão. Qual alternativa descreve corretamente a fórmula química e o nome oficial dessa substância?