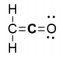
A molécula orgânica ceteno (C2H2O) tem a seguinte estrutura de Lewis:
Qual é a hibridização do átomo de carbono central do ceteno?
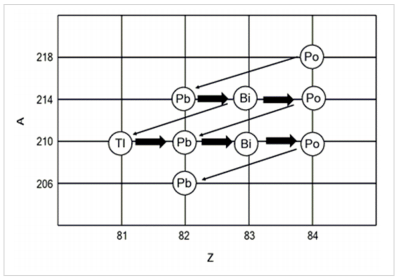
Alguns núcleos são instáveis e tendem a sofrer decaimento até que um núcleo mais estável seja formado. Esses núcleos decaem uma série de etapas e dão origem a uma série radioativa. Na figura a seguir, está mostrado o decaimento do 218Po até 206Pb.
Com relação a decaimento, considere as seguintes equações:
São equações de decaimento:
Equilíbrios químicos são fenômenos comuns às reações químicas. Em poucas palavras, numa reação que tende ou que já atingiu o equilíbrio, os reagentes se convertem em produtos e os produtos regeneram os reagentes, sendo que a posição equilíbrio pode ser determinada a partir da constante de equilíbrio (K eq), que leva em consideração a concentração, no equilíbrio, das espécies envolvidas. Considere que uma reação química genérica atingiu o equilíbrio químico e que a equação da constante de equilíbrio dessa reação é a apresentada a seguir:

Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1- as concentrações de A, B, C e D são iguais.
2- as concentrações de A, B, C e D não se alteram com o tempo.
3- a reação para de acontecer, logo, a formação de produtos é interrompida.
4- a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
Uma vez que entalpia (H) é uma função de estado, ∆H depende apenas dos estados inicial e final do sistema. A variação de entalpia de um processo é a mesma se o processo for realizado em uma etapa ou em uma série de etapas. Com base nisso, considere a transformação do carbono grafita em carbono diamante. Sabendo que a entalpia de combustão da grafita é -393,5 kJ mol-1, e que a entalpia de combustão do diamante é -395,4 kJ mol-1, qual é a entalpia de conversão, em kJ mol-1, de 2 mols de grafita em diamante?
Considere os seguintes fenóis:
A ordem crescente de acidez desses fenóis é:
A fórmula química de um composto representa sua composição em termos de símbolos químicos dos elementos que compõem uma determinada substância. A xantofila, uma substância encontrada em penas de aves e em flores, contém átomos de carbono, hidrogênio e oxigênio na razão 20:28:1. Sabendo que uma molécula desse composto tem seis átomos de oxigênio, qual é a fórmula química da xantofila?
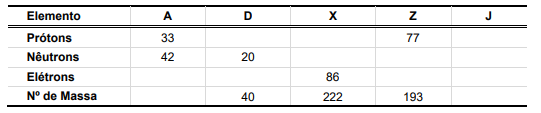
O avanço nas técnicas de análises de espécies químicas diversas permite o descobrimento de fenômenos importantes, como o ocorrido com a espectrometria de massas, técnica que permitiu identificar que átomos de um mesmo elemento podem apresentar massas diferentes. Essa observação foi definitiva para o refinamento do modelo nuclear, com a descoberta de uma nova partícula subatômica – o nêutron – e a identificação de isótopos. Considere a seguinte tabela:
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
A energia livre de Gibbs (G) é uma função de estado termodinâmica que combina as duas funções de estado, entalpia (H) e entropia (S). Para processos que ocorrem a temperatura constante, tem-se que ∆G = ∆H – T∆S. Para um processo ou reação ocorrendo a temperatura e pressão constantes, o sinal de ∆G relaciona-se à espontaneidade do processo. Nesse sentido, sobre a termodinâmica das reações químicas, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
( ) Se ∆G = 0, a reação não ocorre.
( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto).
( ) Se ∆G < 0, a reação é espontânea no sentido direto (reagentes -> produtos).
( ) Se ∆G > 0, a reação é espontânea no sentido indireto (produtos -> reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A concentração dos vapores oriundos de uma solução ideal contendo dois ou mais componentes voláteis pode ser diferente das concentrações dos componentes em solução. Assim, as pressões parciais dos vapores acima da solução serão dadas pela Lei de Raoult, e a pressão vapor total (Ptotal) será a soma das pressões parciais de cada componente. Considere como ideal uma mistura a 20 ºC contendo 1,0 mol de benzeno (Pº = 75 torr) e 2,0 mols de tolueno (Pº = 22 torr). Qual é a pressão de vapor total, em torr, sobre essa solução?
A fermentação da glicose (C 6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não balanceada abaixo:

(Massas molares (g mol
-1): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
Soluções aquosas que contêm um par ácido-base conjugado fraco podem resistir drasticamente às variações de pH com a adição de pequenas quantidades de ácido ou base forte. Elas são chamadas de soluções-tampão (ou simplesmente tampão). Nesse sentido, qual é a quantidade de matéria, em mol, de NH 4Cl que deve ser adicionada a 2,0 L de 0,10 mol L-1 de NH3 para formar um tampão cujo pH é 9,00? Suponha que a adição de NH4Cl não altere o volume da solução.
(Dados: Kb = 1,8 x 10-5 ; pOH = 14,00 – pH)
Em dias muito frios, é comum que encanamentos de água se rompam devido ao processo de congelamento. Esse fenômeno é atribuído ao fato de a água se expandir ao congelar. Quanto trabalho, em joules, uma amostra de 100 g de água realiza ao congelar em 0 ºC e estourar um cano de água que exerce uma pressão oposta de 1,070 atm?
(As densidades da água e do gelo, em 0 °C, são 1,00 e 0,92 g cm-3, respectivamente. w = - Pext ∆V; 1 L atm = 101,325 J)
A diferença de potencial entre dois eletrodos em uma célula voltaica fornece a força eletromotriz que empurra os elétrons por um circuito externo. Para uma pilha, essa força é denominada potencial da célula (E). Sob condições-padrão (concentração das soluções de 1 mol L-1, pressão 1 atm e 25 ºC), tem-se o potencial-padrão da célula (Eºcélula), que pode ser determinado pela diferença dos potenciais-padrão de redução das reações que acontecem no catodo (Eºcatodo) e anodo (Eºanodo). Sabendo que os Eº das células voltaicas Zn-Cu2+, Ni-Cu2+ e Zn-Fe2+ são +1,10, +0,62 e +0,32 V, respectivamente, assinale a alternativa que apresenta o Eº da célula voltaica Fe-Ni2+.
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de 0,125 mol L -1 de AgNO3?
(Massas molares (g mol-1): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
Considere a reação ácido-base entre amônia e água mostrada a seguir:

Com base nessa reação, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
( ) A constante de basicidade da reação será Kb = [NH4+][HO-]/[NH3].
( ) A adição de NH4Cl deslocará o equilíbrio no sentido dos produtos.
( ) A água é um ácido mais fraco do que o íon amônio (NH4+), e o equilíbrio está deslocado no sentido dos reagentes.
( ) A amônia (NH3) é uma base mais forte do que o íon hidróxido, e o equilíbrio da reação está deslocado no sentido dos reagentes.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.