Julgue o item subsecutivo a respeito de redes de computadores e conceitos de proteção e segurança.
Situação hipotética: Ao processar um código executável malicioso que havia recebido como anexo de um email, Mateus percebeu que um malware havia infectado seu aparelho e que, automaticamente, havia sido enviada uma mensagem idêntica, com um anexo malicioso idêntico, a todos os contatos de sua lista de endereços, a partir do seu aparelho. Assertiva: Essa situação é um exemplo clássico de infecção de vírus de computador.
Julgue o próximo item, a respeito de computação na nuvem, sistemas de informações e teoria da informação.
Atualmente, as empresas de comércio na Internet podem disponibilizar suas aplicações na nuvem, como, por exemplo, na plataforma Azure da Microsoft; da mesma forma, as organizações podem fazer migrar suas aplicações de email para a nuvem. Essas nuvens oferecem ambientes de computação e armazenamento escaláveis, mas, por questões afetas à segurança, impedem o acesso implícito às suas redes privativas de alto desempenho.
Com relação à programação Python e R, julgue o item que se segue.
Considere os comandos a seguir, na linguagem R, os quais serão executados no ambiente do R, e considere, ainda, que > seja um símbolo desse ambiente.
Nesse caso, após a execução dos comandos, será obtido o resultado a seguir.
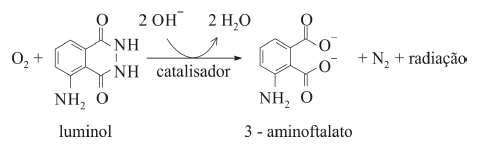
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
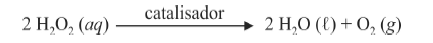
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Na molécula do luminol, os hidrogênios do grupo NH2 ligado ao anel aromático são mais ácidos do que os hidrogênios dos grupos NH presentes no segundo ciclo.
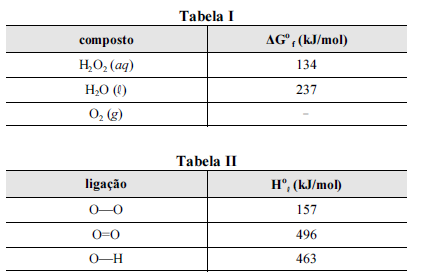
A seguir são apresentadas informações referentes à reação de decomposição do H 2O2.
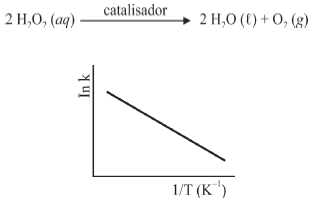
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é y = 30 - 3,0 × 10 4 x.
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGº f) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (Hº l), respectivamente.
Considerando que a reação de decomposição do H 2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue os itens subsequentes, acerca da reação em questão.
O tempo necessário para que a concentração de H2O2 caia a 10% do valor inicial equivale a 10 × ek, em que k é a constante de velocidade da reação de decomposição do H2O2.
A seguir são apresentadas informações referentes à reação de decomposição do H 2O2.

A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é y = 30 - 3,0 × 10 4 x.
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGº f) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (Hº l), respectivamente.
Considerando que a reação de decomposição do H 2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue os itens subsequentes, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de equilíbrio da reação de decomposição do H2O2 é superior ao verificado em temperaturas mais baixas.
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O 2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 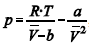
A temperatura T2 é inferior àquela verificada imediatamente antes da compressão.
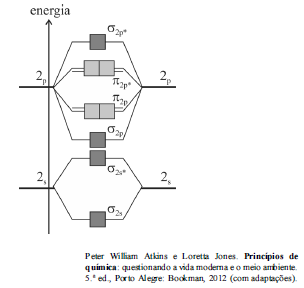
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2 + possui ordem de ligação maior do que a molécula neutra de O2.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
Se o espectro de absorção UV-vis da solução de um certo composto puro apresentar duas transições eletrônicas, então as absorvâncias nesse espectro estarão altamente correlacionadas e dependerão apenas de um único fator, a concentração.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
O rendimento quântico é uma medida da taxa de eventos induzidos pela radiação dividida pela taxa de absorção de fótons.
A cromatografia é um método físico-químico de separação, identificação e quantificação de componentes de uma mistura e seu uso é difundido em diversas áreas, inclusive na área forense. Tendo em vista que esse método pode ser executado de diferentes maneiras, julgue o seguinte item.
O tempo de retenção dos componentes de uma amostra depende da sua afinidade com a fase estacionária; se essa afinidade for grande, o tempo de retenção também será grande.
Tendo em vista que as fibras têxteis são formas comuns de evidências encontradas em uma cena de crime, e que diferentes técnicas analíticas podem auxiliar na identificação dessas evidências, entre elas a espectroscopia no infravermelho e a espectrometria de massas, julgue o item que se segue, relativo a essas técnicas analíticas.
Na espectrometria de massas, um composto é ionizado, os íons são separados de acordo com sua razão massa/carga e o número de íons representando cada razão é registrado em um espectro.
Alguns reagentes específicos podem ser empregados na identificação de drogas ilícitas, por meio da formação de produtos coloridos e rapidamente identificáveis a olho nu, como o reagente de Marquis, empregado para identificar metanfetaminas; o reagente de Scott, usado para identificar cocaína; e o reagente de Simons, usado para discriminar entre anfetaminas e metanfetaminas. Tendo o texto precedente como referência inicial, julgue o item subsecutivo, relativo a aspectos diversos pertinentes a química analítica.
Se uma amostra apreendida contiver anfetamina, metanfetamina e cocaína, esses componentes poderão ser facilmente identificados a olho nu por cromatografia em camada delgada, sem a necessidade do uso dos indicadores citados no texto em apreço.
Uma empresa da área farmacêutica com sede no Canadá desenvolveu um novo fármaco no laboratório da cidade de Toronto em parceria com duas universidades da região. O medicamento, que utiliza como princípio ativo uma droga psicoativa cujo uso recorrente pode levar à dependência física ou psicológica, promete ser um importante aliado de pessoas que desejem abandonar o consumo de cigarros.
A partir dessa situação hipotética, julgue o item a seguir de acordo com a Lei n.º 6.360/1976 e suas alterações.
Modificações na formulação do novo fármaco canadense poderão ser feitas sem a necessidade de autorização do Ministério da Saúde desde que não sejam alterados os compostos químicos utilizados na formulação.
Com relação à legislação que regulamenta o setor de agrotóxicos no Brasil, julgue o item subsequente.
Mesmo em regiões de pequenos produtores, que utilizam baixas quantidades de agrotóxicos, é vedado aos comerciantes retalhar embalagens sem autorização prévia do responsável técnico do produto e das autoridades competentes.