p style="text-align: center;">
Na hemoglobina, um íon Fe 2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto.
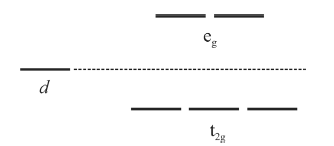
A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe 2+ é d6, julgue o próximo item, de acordo com a teoria do campo cristalino.
Na hemoglobina com uma molécula de H2O substituindo a molécula de O2, a energia de estabilização do campo cristalino é igual a -0,4 × Δoct, em que Δoct é o valor do desdobramento do campo cristalino.
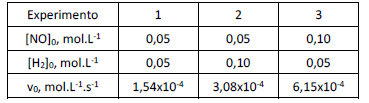
As velocidades iniciais (v0) da reação
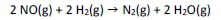
foram determinadas em diferentes experimentos, nos quais as concentrações iniciais dos reagentes ([NO] 0 e [H2]0) eram variadas.
Os resultados estão resumidos na tabela a seguir.
Nas condições deste experimento, a lei de velocidade da reação é
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O
2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 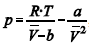
A partir do gráfico apresentado, conclui-se que o CO2 (g) apresenta a constante b na equação de van der Waals inferior à do O2 (g).
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O
2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 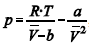
Quando atingida a pressão de 300 atm e a temperatura T2, o volume ocupado pelo gás será menor do que aquele que seria ocupado, nas mesmas condições, por um gás ideal.
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O 2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 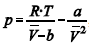
A temperatura T2 é inferior àquela verificada imediatamente antes da compressão.
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O
2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 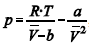
A uma pressão de 1,00 atm e temperatura de 300 K, o volume ocupado pelo O2 (g) formado na decomposição de 4,00 mol de H2O2 será superior a 46,0 L.
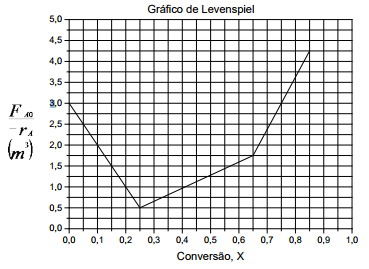
Um engenheiro químico trabalhando com a reação adiabática A⇄B obteve dados cinéticos, que foram tratados e representados no gráfico de Levenspiel a seguir.
Neste processo, deve-se empregar três reatores em série, dois CSTR´s e um PFR, arranjados livremente. Considerando que as conversões na saída dos reatores 1, 2 e 3 são 25%, 65% e 80%, respectivamente, o volume total (V1+V2+V3) mínimo do sistema de reatores é?
A velocidade de degradação da substância A obedece a
uma expressão de primeira ordem, sendo:
CA a concentração da substância A a qualquer tempo t;
CA0 a concentração da substância A no tempo inicial t0;
K a constante de velocidade.
É possível calcular a concentração de A, após um determinado
tempo de reação, por meio da equação:
A expressão de grau de cobertura de um catalisador foi
dada como:

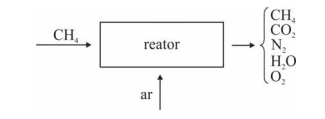
Em um reator ideal, de processo contínuo, que opera em
estado estacionário, a combustão de CH4 ocorre com uma
conversão de 90% do reagente limitante. Esse reator é alimentado
com CH4 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente,
conforme ilustrado no esquema apresentado.
Considerando que, nessa situação, a combustão do CH4 seja
completa e que a composição do ar que alimenta o reator seja de
24%, em massa, de O2 (g) e, o restante, de N2 (g), julgue o item
subsequente.
A porcentagem, em massa, de CO2 na corrente de saída do
reator é superior a 10%.

Considerando que as reações de hidrogenação sejam exotérmicas,
que todos os gases envolvidos apresentem comportamento ideal e
que o produto da constante universal dos gases pela temperatura
absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se
seguem.
A constante de equilíbrio para a reação de hidrogenação do
C2H4 (g) a 100 ºC é maior que a 25 ºC.

Considerando que as reações de hidrogenação sejam exotérmicas,
que todos os gases envolvidos apresentem comportamento ideal e
que o produto da constante universal dos gases pela temperatura
absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se
seguem.
Considere que a reação de hidrogenação em apreço seja de
ordem um com relação ao C2H4 (g) e de ordem um com relação
ao H2 (g), e que as concentrações iniciais de cada um dos dois
reagentes sejam iguais a x0. Nessas condições, a concentração
de C2H4 em um instante t da reação é dada por x0/(1 + k'.t.x0),
em que k' é a constante de velocidade na temperatura da
reação.

Considerando que as reações de hidrogenação sejam exotérmicas,
que todos os gases envolvidos apresentem comportamento ideal e
que o produto da constante universal dos gases pela temperatura
absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se
seguem.
A energia de ativação da reação de hidrogenação catalisada
pelo metal B é superior à da reação catalisada pelo metal A.
Com relação às misturas de vapor d'água com ar atmosférico em
determinada temperatura ambiente e volume fixo, julgue os itens
subsequentes.
A umidade absoluta é calculada pela razão da massa de vapor
d'água no ar pela massa de ar seco, ao passo que a umidade
relativa é determinada dividindo–se a pressão de vapor pela
pressão atmosférica.

Considerando que as reações de hidrogenação sejam exotérmicas,
que todos os gases envolvidos apresentem comportamento ideal e
que o produto da constante universal dos gases pela temperatura
absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se
seguem.
Sob determinada temperatura, a reação de hidrogenação do
C2H4 (g) liberará maior quantidade de calor se realizada a
volume constante, e não a pressão constante.