Com base em conceitos de termodinâmica e noções de instrumentação, julgue os próximos itens.
Se, em determinada situação, um instrumento de medição de corrente elétrica, com faixa de medida (range) de 100 mA a 20 A e exatidão de 10% de fundo de escala, apresentar valor medido igual a 15 A, então o valor real da corrente elétrica que se está medindo será dado por 15 A ± 2 A.
Com base em conceitos de termodinâmica e noções de instrumentação, julgue os próximos itens.
Considere um instrumento de medição de temperatura ajustado para alcance (span) de 100 oC; considere, ainda, que o limite inferior da capacidade de medida ou de transmissão desse instrumento seja de 50 oC. Nessa situação, o limite superior dessa capacidade de medida ou de transmissão é de 150 oC.
Com base em conceitos de termodinâmica e noções de instrumentação, julgue os próximos itens.
O tubo de Bourdon consiste em instrumento de medição de temperatura por dilatação de líquido que preenche o referido tubo, o qual, por sua vez, é normalmente fabricado em vidro com propriedades térmicas adequadas às variações de temperatura cobertas pelo medidor.
Com base em conceitos de termodinâmica e noções de instrumentação, julgue os próximos itens.
Uma máquina que realiza 1.000 J de trabalho ao retirar 3.000 J de calor de um reservatório que está à temperatura de 750 K possui eficiência térmica inferior a 35%.
Um motor, quando não está devidamente lubrificado, possui um rendimento η =1/3, liberando uma certa quantidade de calor Q0 quando em funcionamento. Quando corretamente lubrificado, seu rendimento aumenta em 30%.
Nessas condições, a nova quantidade de calor liberada pelo motor será
Durante um processo termodinâmico de expansão em um gás, observa-se que TV2 = constante, onde T é a temperatura, e V é o volume do gás. O trabalho realizado na expansão entre V0 e 2V0 é W1 , e o trabalho realizado na expansão entre 2V0 e 3V0 é W2.
Se é válida a relação dos gases ideais, pV = nRT, qual a razão W2/W1?
Ao colocarmos 100 mL de água quente à temperatura 2T0 Celsius em 100 mL de água fria, observamos que, após algum tempo, a mistura atinge a temperatura de equilíbrio 3T0/2 Celsius.
Se colocarmos os mesmos 100 ml de água quente no dobro da quantidade de água fria, a nova temperatura de equilíbrio será?
Uma máquina térmica opera em ciclos retirando calor Q1 = 300 J de uma fonte térmica quente, T1 = 600 K, e rejeitando Q2 = 200 J em uma fonte fria T2 = 300 K, a cada ciclo, em que a diferença entre esses valores corresponde ao trabalho produzido por ciclo.
Dado que as únicas trocas de calor da substância de trabalho da máquina com as fontes externas são essas duas descritas acima, qual é o rendimento térmico da máquina?
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O
2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 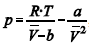
Quando atingida a pressão de 300 atm e a temperatura T2, o volume ocupado pelo gás será menor do que aquele que seria ocupado, nas mesmas condições, por um gás ideal.
Um cilindro metálico, de comprimento L e de seção reta circular de raio R, está submetido em suas extremidades circulares a temperaturas T e T +ΔT. A superfície lateral do cilindro está isolada termicamente. O cilindro, então, conduz calor de modo que o fluxo entra pela superfície a temperatura T +ΔT e sai pela superfície a temperatura T, a uma distância L da primeira. A condutividade térmica do material que constitui o cilindro é k. Um outro cilindro é construído com um material diferente, de modo que sua condutividade térmica é k', seu raio é R' =2R, e seu comprimento é L' = 2L, mas esse outro cilindro conduz exatamente a mesma quantidade de calor por unidade de tempo que o primeiro cilindro, quando submetido à mesma diferença de temperatura ΔT.
Nessas condições, o valor da razão k'/k é
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O 2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 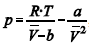
A temperatura T2 é inferior àquela verificada imediatamente antes da compressão.
Uma placa de cerâmica, com emissividade térmica ε0, é aquecida a temperatura T0 apresentando uma taxa de emissão de calor de Q'0.
Se a emissividade térmica for reduzida em 20%, e a temperatura for dobrada, a nova taxa de emissão de calor será
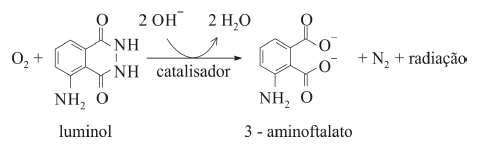
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
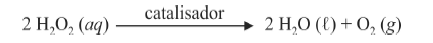
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A molécula de H2O2 é apolar e apresenta menor ponto de ebulição normal do que a água.
O O 2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O
2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 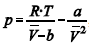
A uma pressão de 1,00 atm e temperatura de 300 K, o volume ocupado pelo O2 (g) formado na decomposição de 4,00 mol de H2O2 será superior a 46,0 L.
A destilação é uma operação unitária que tem por objetivo separar os constituintes de uma mistura líquida por
meio da diferença de volatilidade. No desenvolvimento
de projetos de colunas de destilação para a separação de
compostos binários (A e B), a figura a seguir é bastante
prática e amplamente utilizada.
Diagrama isobárico da temperatura em função
da fração molar do componente A
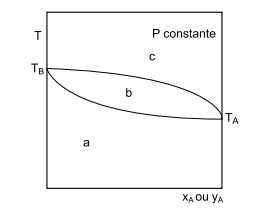
Com relação à figura apresentada, é correto afirmar que