A solubilidade do cloreto de chumbo, em água a 25 °C, é 1,6x10-2 mol L-1. Portanto, a constante do produto de solubilidade é, aproximadamente, igual a
Para uma molécula com mais de dois átomos o momento de dipolo depende tanto das polaridades das ligações individuais quanto da geometria da molécula. Considerando as seguintes moléculas poliatômicas, BF3, CO, SO2, CF4, NCl3 e SF2, quais são polares?
Substâncias no equilíbrio que estejam em fases diferentes dão origem aos equilíbrios heterogêneos. Um exemplo é representado pela equação a seguir:
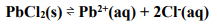
A expressão da constante de equilíbrio que representa a referida equação é:
Um analista precisa preparar 500 mL de uma solução aquosa 0,2 mol L -1 de ácido clorídrico a partir de uma solução comercial da qual extrai-se do rótulo do recipiente as seguintes informações: Teor mínimo = 37% (m/m); Densidade = 1,18 g mL-1; Massa molar = 36,5 g mol-1 .
O volume da solução comercial, em mL, a ser utilizado pelo analista, deve ser de, aproximadamente,
Os compostos que possuem o grupo carbonila (C=O), em razão da natureza de suas moléculas, apresentam diferentes reatividades em reações de adição nucleofílica.
Nessas reações, a molécula mais reativa é a de
Os rótulos dos reagentes contêm etiquetas apropriadas para indicar os riscos químicos, apresentados na forma de losango com quatro áreas coloridas. As cores azul, vermelha e amarela indicam, respectivamente, riscos associados à
Uma solução de HCl 5x10 -8 mol L-1 foi preparada em água à temperatura ambiente. Considerando o valor da constante do produto iônico da água (Kw) igual a 1x10-14, a percentagem de íons H+ proveniente da solução de HCl é igual a
Uma mistura equimolar de acetato de sódio e ácido acético foi preparada em água para formar uma solução tampão. Considerando o Ka do ácido acético igual a 2x10-5, o pH da solução preparada apresentou valor igual a
Átomos ou íons que apresentam o mesmo número de elétrons são denominados espécies isoeletrônicas. Nas espécies isoeletrônicas F-, Na+ , Mg2+ e Al3+, o íon
Considere quatro elementos químicos genéricos, representados por A, B, C e Z. Os elementos A e Z pertencem ao mesmo grupo da tabela periódica; os elementos A, B e C apresentam números atômicos consecutivos; e B é um gás nobre. Dessa forma,
A dureza da água está relacionada à presença de íons metálicos (M 2+) dissolvidos em determinado volume de amostra. Nesse contexto, para determinar a dureza da água, um volume de 50 mL foi titulado com uma solução 0,01 mol L-1 de EDTA, gastando-se um volume médio de 7 mL dessa solução. A equação química geral representativa do processo está descrita a seguir.
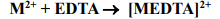
A dureza da água, expressa em mg de CaCO3 por litro de amostra, é igual a
Um haleto de alquila terciário deve ser submetido às condições reacionais que favoreçam reações de substituição nucleofílica SN1.
Esse tipo de reação é favorecida por
O grafeno é um alótropo do carbono e apresenta propriedades elétricas atrativas para o desenvolvimento de sensores. Nesse material, a hibridização dos átomos de carbono é:
concentração de ácido lático (HX) presente em uma amostra foi determinada por análise volumétrica. No experimento, 1,0 mL da amostra foi transferido para um balão de 100 mL. Em seguida, 10 mL dessa solução foram transferidos para um erlenmeyer e titulados com NaOH 0,050 mol L-1. Considerando a proporção estequiométrica igual a 1:1 e que o volume gasto da solução de NaOH foi igual a 5,0 mL, a concentração de HX, em mol L-1, na amostra foi igual a
Compare os íons Ca²+ e S²-, oriundos dos átomos fundamentais dos elementos 20Ca40 e 16S32. Ambos têm em comum o fato de que possuem


