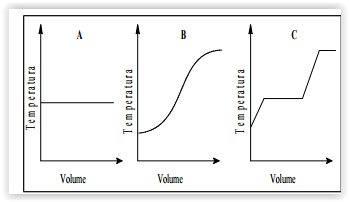
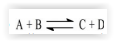As destilações das seguintes soluções: 1) líquido puro; 2) dois
líquidos com pontos de ebulição 70 e 120 °C; 3) dois
líquidos com pontos de ebulição 120 e 135 °C produziram
as seguintes curvas de destilação:
Com base nestas informações, os gráficos A, B e C
representam, respectivamente, destilações:
Recipiente cheio de tetracloreto de carbono gasoso, pesado em determinada temperatura e pressão, e posteriormente esvaziado e cheio de oxigênio gasoso, na mesma temperatura e pressão, terá o peso do vapor de tetracloreto de carbono aumentado em relação ao do oxigênio, em aproximadamente:
A equação
descreve a reação entre dois
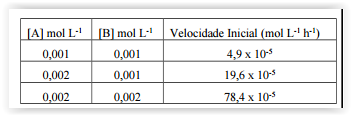
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3 h-1, é:
Considere uma pessoa adulta, em repouso, com um gasto
energético de 2000 kcal e consumo de 2500 kcal em um dia, na
forma de alimentos. Suponha, também, que 70% do seu peso
corporal de 80 kg vem da água que constitui seu corpo. Calcule
a energia, em kcal, que o corpo humano teria em excesso se,
além do repouso, a temperatura da água corporal aumentasse
de 36,5 para 38 oC:
Considere que 1 cal equivale à energia
necessária para elevar de 1 °C a temperatura
de 1 g de água
A reação química (CH3)3CCl + 2H2O→ (CH3)3COH + H3O+ + Cl-, acontece em três etapas, sendo a primeira a etapa lenta da reação. O gráfico que representa a cinética dessa reação química é:
Alguns pr°Cessos de obtenção de H2SO4 utilizam pirita (FeS2) como matérIa-prima no lugar de enxofre elementar (S8).
Esses pr°Cessos podem ser descritos resumidamente pelas seguintes equações, nas quais se pode notar varIações no
estado de oxidação do enxofre:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
De acordo com o texto, assinale a alternativa que apresenta os estados de oxidação do enxofre nas espécies FeS2, SO2,
SO3 e H2SO4, respectivamente.
A queima de enxofre elementar gera compostos gasosos responsáveis pela formação da chuva ácida, com consequente
deterioração de edificações e de monumentos construídos em mármore, acompanhada de liberação de gás carbônico na
atmosfera. Esse pr°Cesso pode ser ilustrado pelas seguintes reações não balanceadas:
S + O2 → SO2
SO2 + O2 → SO3
SO3 + H2O → H2SO4
H2SO4 + CaCO3 → CaSO4 + H2CO3
H2CO3 → CO2 + H2O
Considerando essa sequêncIa de eventos, assinale a alternativa que apresenta a equação global balanceada dos eventos
supracitados.
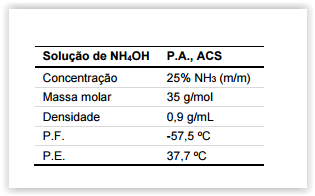
Foi requisitado a um técnico de laboratório que preparasse uma
solução de hidróxido de amônio, a partir de uma solução comercIal
concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
Assinale a alternativa que indica o volume aproximado da solução
comercIal (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
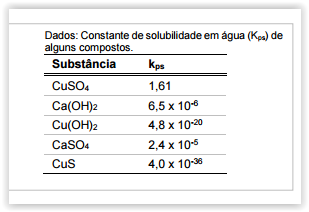
A calda bordalesa, muito utilizada como fungicida na agricultura, é
preparada pela mistura de sulfato de cobre pentaidratado
(CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em
proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma
suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a
alternativa que apresenta o constituinte principal do sólido suspenso
na calda bordalesa.
Assinale a alternativa que apresenta um exemplo de fenômeno químico.
A substância cujas moléculas são formadas exclusivamente por li gações covalentes é apresentada na alternativa:
Considere a seguinte situação:
Uma solução apresenta pH=9,0.
O reagente indicado para se ajustar o pH dessa solução a pH=7,0 está apresentado na alternativa:
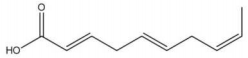
A esteroquímica das ligações duplas nas posições 2, 5 e 8 do composto cuja estrutura é representada a seguir apresentam, respectiva mente, as configurações:
Em um laboratório de química analisou-se uma substância orgânica e determinou-se sua composição percentual como segue: C (40,9%), H (4,6%) e O (54,5%). A fórmula mínima da substância é:
Considere a equação de equilíbrio a seguir:

Sabe-se que os valores de entalpia padrão de formação (ΔH°f ), em kJ mol -1 à 25 °C são: NH3 = -46, N2 e H2 = 0.
Se a temperatura desse sistema em equilíbrio for aumentada, o equilíbrio será deslocado no sentido de aumentar a concentração