Assinale a alternativa que contenha o reagente correto para a formação do dióxido de nitrogênio que represente corretamente a afirmação II:
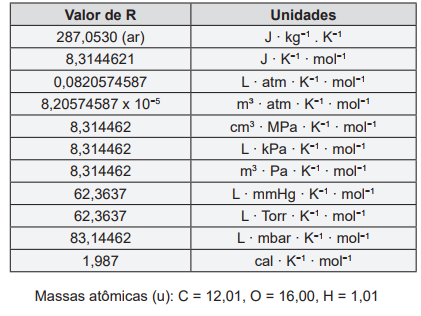
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 .
Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
A velocidade da reação: N2 + 3 H2 → 2 NH3 pode ser calculada pela expressão (k é a constante de velocidade): (x e y são constantes experimentais)
Analise as seguintes afirmativas e a seguir assinale a alternativa correta:
I. Um tanque de oxigênio armazenado fora de um edifício tem uma pressão de 20,00 atm às 6:00 h da manhã, quando a temperatura está em torno de 10°C. A pressão no tanque às 18:00 h quando a temperatura chega a 30°C é 21,41 atm.
II. Um motor de automóvel mal ajustado pode liberar, em marcha lenta, até 1,00 mol de monóxido de carbono por minuto. A 27°C, o volume desse gás, a 1 atm de pressão que pode ser liberado por minuto é 24,61 L.
III. O óleo produzido a partir de folhas de eucalipto contém o composto volátil eucaliptol. Esse composto tem densidade 0,320 g L-1 a 190°C e 60,0 mmHg. A massa molar do eucaliptol gasoso é 153,89 g mol-1.
IV. O volume de gás carbônico (a 25°C e 1 atm) necessário para que uma planta produza 1,00 g de glicose (C6H12O6) por fotossíntese é 815 mL.
V. A composição do ar seco, em volume, é: 78% de nitrogênio, 21% de oxigênio e 1% de argônio. As pressões parciais desses gases no ar a uma pressão atmosférica de 1 atm são respectivamente, p(N2) = 0,78 atm, p(O2) = 0,21 atm e p(Ar) = 0,01 atm.
Assinale a alternativa correta:
Assinale a alternativa que completa corretamente as lacunas do texto, correta e respectivamente.

Assinale a alternativa correta:
Sobre como a estrutura dos compostos orgânicos afeta suas propriedades, tanto físicas quanto químicas, considere as afirmações a seguir e assinale a alternativa correta.
I. A dimetilamina é mais básica que a metilamina, devido ao efeito mesomérico
II. O ácido tricloroacético é mais ácido que o ácido acético, devido ao efeito de campo ocasionado pelos átomos de cloro.
III. A polaridade de um composto orgânico é exclusivamente dependente da presença de ligações polares, portanto, havendo ligações polares o composto será polar.
IV. O ponto de ebulição do ácido trans-butenodioico (ácido fumárico) é maior que o do ácido cis-butenodióico (ácido maleico)
V. Isômeros ópticos têm exatamente a mesma densidade, mesmos pontos de fusão e ebulição e mesma solubilidade em solventes não quirais.
Assinale a alternativa correta:
As reações de substituição nucleofílicas alifáticas:
I. São favorecidas por solventes polares próticos.
II. Podem resultar em misturas de isômeros ópticos.
III. Podem apresentar como produtos secundário alcenos.
IV. Podem ser mono ou bimoleculares.
V. Podem apresentar rearranjos.
Assinale a alternativa correta:
O ciclo do carbono está intimamente relacionado com os seres vivos que vivem sobre a superfície terrestre. Existem vários tipos de compostos de carbono nas diversas etapas que compõem o ciclo. Esses compostos podem ser líquidos, sólidos e gasosos. Muitos deles são sintetizados pelos organismos vivos, com números de oxidação variando de +4 a -4. Contudo, o transporte de carbono entre os vários compartimentos (atmosfera, hidrosfera e litosfera) é feito, principalmente, pelo carbono com número de oxidação +4 na forma de gás carbônico, carbonato ou bicarbonato. Sobre o ciclo do carbono, analise as afirmativas que seguem e assinale a alternativa correta:
I. No ciclo do carbono o gás carbônico na forma de gás é absorvido pelos vegetais durante a fotossíntese para formar a massa vegetal.
II. Já os seres humanos e todos os demais seres vivos, ao respirarem, tanto aeróbica como anaerobicamente, liberam gás carbônico e energia, que pode ser aproveitada de diversas formas, inclusive por outros organismos.
III. As reações de dissolução do gás carbônico em água são reações de equilíbrio, em fase líquida aquosa. Essas reações em equilíbrio podem participar de mecanismos de transporte de gás carbônico em meios aquosos tão diferentes como os que existem nos oceanos e do transporte de CO2 entre células e pulmões feito pelo sangue.
IV. Os mesmos equilíbrios interagindo com íons metálicos podem resultar na formação de esqueletos e carapaças de organismos como conchas, casca de ovos ou na formação e dissolução de rochas e sedimentos.
V. O ser humano interfere globalmente no ciclo do carbono adicionando quantidades significativas de gás carbônico na atmosfera, quando utiliza qualquer combustível contendo carbono proveniente de fonte não renovável.
Assinale a alternativa correta:
Para um certo líquido, o ponto normal de ebulição é 400 K. O calor de vaporização pode ser calculado pela equação: ΔH = 13500 -10 T (cal mol-1). Admitindo que seu vapor se comporte como gás ideal e que o volume do líquido seja desprezível quando comparado com o do vapor, os valores aproximados de q, w, ΔU, ΔH, ΔS e ΔG, para o processo de vaporização de 1 mol de benzeno a 400 K são:
Dado: 1 cal = ~4,187 J
Com relação à espectrometria de absorção atômica em chama ( F AAS ), considerando a aplicação do procedimento de aspiração contínua (procedimento convencional) de solução de amostras, qual a alternativa com as afirmações incorretas?
I) Pode ser aplicada para a determinação de íons metálicos.
II) É uma técnica instrumental analítica mais sensível para a realização de determinações, em comparação à espectrometria de absorção atômica em forno de grafite ( GF AAS ).
III) Não permite a atomização do analito em um ambiente mais livre da presença de componentes da matriz da amostra.
IV) É uma técnica instrumental analítica fortemente afetada pelo efeito de interferências espectrais.
V) Possibilita a correção de sinais de absorção de fundo que ocorrem em comprimentos de onda da região do visível do espectro eletromagnético, mediante a utilização do sistema instrumental de correção com lâmpada de deutério.
Considere as afirmações abaixo sobre os modos de injeção de amostras empregados na técnica de cromatografia em fase gasosa.
I) No modo Split (com divisor de fluxo), a amostra é dividida antes de entrar na coluna.
II) No modo Splitless (sem divisor de fluxo), toda amostra entra na coluna.
III) No modo Split (com divisor de fluxo), a amostra é dividida antes de entrar na coluna, sempre na razão de 1:50.
IV) No modo Split (com divisor de fluxo), toda amostra entra na coluna.
Assinale a alternativa com as afirmações corretas.
As afirmações abaixo estão relacionadas à fonte de ionização por impacto de elétrons ( EI ) empregada na espectrometria de massas.
I) Aplicada a moléculas de média e de baixa polaridade em qualquer faixa de massa molecular.
II) Empregada na determinação da massa molecular dos compostos devido ao aparecimento do íon molecular em todos os espectros de massas.
III) Empregada na identificação de compostos devido ao grande número de fragmentos formados.
IV) Aplica-se a moléculas de média e de baixa polaridade em analitos com massa molecular inferior a 1.000 daltons.
Assinale a alternativa com as afirmações corretas.
Em um laboratório de ciências, um técnico encontrou dois frascos contendo soluções aquosas com as seguintes informações no rótulo:
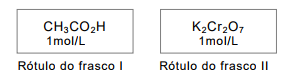
As soluções aquosas dos frascos I e II são, respectivamente, de
O descarte de resíduos provenientes das atividades experimentais em um laboratório de ciências exige determinados cuidados e atenção às normas estabelecidas. Durante várias atividades, um técnico de laboratório observou as seguintes práticas dos estudantes:

As práticas dos estudantes NÃO recomendadas estão presentes nos itens
Visando determinar o teor de umidade de uma amostra de solo contaminado, um perito recolheu 4,860g de amostra previamente homogeneizada para uma cápsula de porcelana de massa igual a 22,148g. Após 6 horas de secagem em estufa a 110°C, seguida de resfriamento em dessecador até temperatura ambiente, a cápsula contendo a amostra de solo apresentou massa igual a 25,451g. Assinale a alternativa que contém a porcentagem de umidade na amostra de solo analisada.