Com base nos conceitos de eletroquímica e de radioquímica,
julgue os próximos itens.
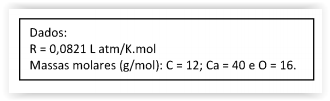
Eletroquímica é o ramo da química que trata do uso de reações químicas para produzir eletricidade, das forças relativas dos agentes oxidantes e redutores e do uso da eletricidade para produzir mudança química.
com referência às estruturas e principais propriedades das
biomoléculas, julgue os itens que se seguem.
Proteínas são polímeros feitos de unidades de carboidratos. Sua estrutura primária é o empacotamento de unidades individuais de proteína juntas; a estrutura secundária, o dobramento em uma unidade compacta; a estrutura terciária é a formação de hélices e folhas; e a estrutura quaternária é a sequência de resíduos de aminoácidos.
A química ambiental trata das reações, dos destinos,
dos movimentos e das fontes das substâncias no ar, na água
e no solo. Na ausência do ser humano, a discussão seria
limitada às substâncias de ocorrência natural. Hoje, com o
borbulhar da população na Terra, junto com o contínuo
avanço da tecnologia, as atividades humanas têm uma
influência sempre crescente na química do meio ambiente.
C. Baird e M. Cann. Química ambiental.
4ª ed. Porto Alegre: Bookman, 2011
Julgue os itens subsecutivos com relação à química e ao meio
ambiente.
A chuva ácida abrange uma variedade de fenômenos correspondentes à precipitação atmosférica de quantidades substanciais de ácidos. Os dois ácidos predominantes na chuva ácida são o ácido sulfúrico (H2SO4) e o ácido nítrico (HNO3), ambos ácidos fortes.
Considere a reação 2CI
2(g) + 2H2O(g)  4HCI(g) + O2(g) (ΔH = 113 kJ.mol-1) e admita que o sistema está em equilíbrio. O que ocorre ao número de moléculas de H2O no recipiente se:
4HCI(g) + O2(g) (ΔH = 113 kJ.mol-1) e admita que o sistema está em equilíbrio. O que ocorre ao número de moléculas de H2O no recipiente se:
I - For adicionado O2 ?
II - For adicionado Cl2?
III - O volume do recipiente for diminuído?
IV - A temperatura for diminuída?
Assinale a alternativa que responde corretamente as perguntas acima:
O diagrama abaixo representa a variação de energia durante a reação: A  B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:
B. Assinale a alternativa que corresponde à sequência correta para preenchimento das lacunas:

( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
Sobre a tabela periódica, em particular sobre energia de ionização, considere as afirmações a seguir:
I. A primeira energia de ionização é maior para os elementos próximos do hélio e menor para os próximos do césio.
II. A segunda energia de ionização é maior do que a primeira energia de ionização do mesmo elemento.
III. Os metais são encontrados à esquerda da tabela periódica porque esses elementos têm baixa energia de ionização e podem perder elétrons facilmente.
IV. Elementos com energias de ionização altas não devem formar cátions facilmente ou conduzir eletricidade.
V. A energia de ionização é a energia necessária para remover um elétron de um átomo na fase gás. De certo modo ela é de fundamental importância para entender como as ligações químicas são formadas e, portanto, sobre as propriedades físicas das moléculas.
Assinale a alternativa correta:
Considere as reações abaixo, as afirmativas a seguir e assinale a alternativa correta:

I. Segundo a teoria de Brønsted-Lowry, o íon bicarbonato na Reação 1 é um ácido.
II. Segundo a teoria de Lewis, a amônia na Reação 2 é uma base, pois ela doa elétrons.
III. Segundo a teoria de Lewis, o íon bicarbonato na Reação 1 é anfótero.
IV. Segundo Brønsted-Lowry, o íon carbonato na Reação 1 é uma base, chamada de base conjugada do íon bicarbonato.
V. Todas as bases de Brønsted-Lowry mostradas nas equações são também consideradas bases de Lewis.
Assinale a alternativa correta:
Reações químicas são processos importantes que podem acontecer no dia a dia, na indústria, nos organismos dos seres vivos etc., havendo vários indícios de sua ocorrência. Sobre essa temática, considere as situações apresentadas a seguir:

São exemplos de reações químicas as que estão presentes nos itens
A água, por suas propriedades físicas e químicas, é considerada como o "solvente universal", que pode dissolver um grande número de substâncias. Com os dados das solubilidades de uma substância na água, à pressão constante e a uma determinada temperatura, é possível construir gráficos denominados de curva de solubilidade. O gráfico a seguir representa a solubilidade do CO2.
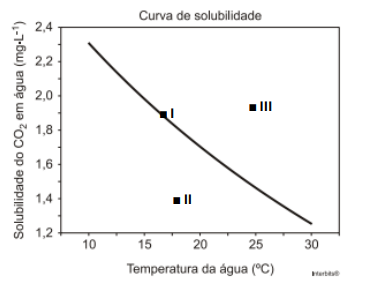
Nesse gráfico, constata-se que
Um técnico de laboratório de ciências precisa de um recipiente com escala entre 50 e 100 mililitros, usada para misturar e dissolver substâncias, e de uma vidraria para armazenar, preparar, aquecer ou recolher soluções. As vidrarias a serem usadas para esses propósitos são, respectivamente,
Em um laboratório de ciências, a limpeza do material de vidro é fundamental para garantir o bom desenvolvimento das atividades experimentais. Durante uma atividade prática, foram realizados alguns procedimentos relacionados com a limpeza da vidraria, detalhados a seguir:

Os procedimentos que revelam práticas INADEQUADAS no laboratório de ciências estão presentes nos itens
O etanol pode ser obtido pela fermentação do caldo da cana-de-açúcar e possui fórmula CH3 CH2OH. Uma amostra de etanol puro, sem água e outros contaminantes, ao ser aquecida, entrará em ebulição a aproximadamente 78°C. As forças intermoleculares que estão atuando, unindo as moléculas de etanol umas às outras, sendo vencidas durante a mudança de fase líquido para vapor, são:
O carbonato de cálcio, CaCO
3(s), decompõe-se com aquecimento para produzir CaO(s) e CO2(g). Uma amostra de CaCO3 é decomposta e o dióxido de carbono é coletado num frasco de 300 mL. Depois de completada a decomposição, o gás tem pressão de 1,5 atm à temperatura de 27°C. Qual é a quantidade aproximada de matéria, em mol de CO2, produzida na decomposição?
Considerando-se a estrutura interna da matéria e a classificação periódica dos elementos, marcar C para as afirmativas Certas, E para as Erradas e, após, assinalar a alternativa que apresenta a sequência CORRETA: (---) Os íons Na+ e O2- são isoeletrônicos. (---) A energia necessária para retirar um elétron de um átomo na fase gasosa é denominada energia de ionização. (---) No modelo de Rutherford-Bohr, os elétrons apresentam energias e órbitas quantizadas.
Com relação ao tamanho de átomos e íons e às propriedades periódicas, assinalar a alternativa CORRETA: