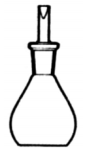
Considere a figura abaixo.
A figura refere-se ao material de laboratório conhecido como
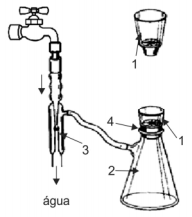
A figura abaixo mostra um equipamento de laboratório para filtração a vácuo.
Os componentes indicados pelos números 1, 2, 3 e 4 correspondem, respectivamente, a
Numa estação de tratamento de esgotos, o biogás gerado como produto da degradação microbiológica do lodo é produzido em ...... e é composto principalmente por ...... que pode ser utilizado como combustível.
As lacunas são, correta e respectivamente, preenchidas por:
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
No Brasil, adiciona-se etanol anidro à gasolina, em proporção estabelecida por lei. O consumidor pode solicitar ao frentista que verifique se essa proporção está sendo obedecida. Para isso, realiza-se um teste que se baseia na separação de fases de uma mistura do combustível com água, em iguais quantidades.
De acordo com o teste, quais fases o consumidor deve visualizar?
O fenol é uma substância orgânica largamente utilizada na indústria química. Contudo, o fenol é corrosivo, irritante das membranas mucosas e causa queimaduras severas. Em contato com a água, dissolve-se e estabelece o equilíbrio.

Em um acidente rodoviário, uma carga de fenol foi derramada sobre a pista.
Para neutralizar o fenol, deve-se utilizar uma substância com caráter
Sobre a chuva ácida, assinale a alternativa que completa corretamente e, respectivamente, as lacunas do texto. Apesar de não ser o único componente para a formação da chuva ácida, o ________________ pode ser formado na reação demonstrada no item III). É verificado que a maior quantidade de nitrogênio para a formação da chuva ácida provem da(e) __________, já que os combustíveis possuem baixa concentração de nitrogênio em sua composição. Outro composto importante na composição da chuva ácida é o _________________, este proveniente da queima dos combustíveis fósseis.
Se colocados 100,0 g de Al(s) e 40,0 g de Cr2 O3 em alta temperatura, ocorrerá uma reação de oxidação de alumínio seguindo a reação: 2 Al(s) + Cr2 O3 (s) → Al2 O3 (s) + 2 Cr(l). Identifique qual será o reagente limitante desta reação e quantifique (em gramas) o excesso de reagente que permanece sem reagir. Dados: 1 mol de Al = 27 g Al, 1 mol de Cr2 O3 = 152,0 g Cr2 O3 .
Assinale a alternativa que possui ambas respostas corretas.
Quais são as espécies predominantes nas soluções aquosas descritas abaixo?
Solução I: solução aquosa de HCl (ácido forte)
Solução II: solução aquosa de NaOH (base forte)
Solução III: solução aquosa de HCN (ácido fraco)
Considere as seguintes afirmativas sobre os compostos de carbono e assinale a alternativa correta:
I. Os compostos orgânicos são muito mais numerosos do que os compostos que não contêm este elemento, pois o carbono pode, dentre outros fatores, formar ligações múltiplas, formar cadeias longas, curtas, lineares, ramificadas, cíclicas, saturadas e insaturadas, ligar-se a diferentes elementos.
II. A ligação insaturada de determinado hidrocarboneto é mais curta e mais forte que qualquer ligação simples de seu determinado análogo saturado, pois a hibridização sp3 de quaisquer dos carbonos do composto saturado não os permite sobrepor seus orbitais com os dos carbonos vizinhos.
III. A hibridização do carbono, dentre outros fatores, afeta a sua estrutura e, portanto, as suas propriedades, sendo as propriedades físicas mais amplamente afetadas que as propriedades químicas.
IV. A reatividade de um carbono terciário é sempre menor que a de um carbono primário, devido ao impedimento estéreo.
V. Compostos contendo ligações triplas, em geral, são mais reativos que seus compostos isólogos.
Assinale a alternativa correta:
Sobre a teoria atômica, considere as seguintes afirmações e assinale a alternativa correta:
I. Dalton chegou à conclusão da existência de átomos com base em observações químicas macroscópicas e não teve evidências diretas da existência de átomos.
II. Os experimentos de Thomson sobre o comportamento dos raios catódicos em campos magnéticos e elétricos proporcionaram a descoberta dos elétrons e permitiram que sua razão carga-massa fosse medida.
III. Os estudos de Rutherford mostraram que o átomo tinha um núcleo denso, carregado positivamente.
IV. De Broglie, Heisenberg, Born, Bohr e Planck foram cientistas que colaboraram para a teoria quântica moderna.
V. A dualidade onda-partícula, o princípio da incerteza, as funções de onda, a equação de Schrödinger, o princípio da exclusão de Pauli são contribuições recentes para a teoria atômica.
Assinale a alternativa correta:
Balanceie as equações químicas de I a V e na sequência assinale a alternativa correta:
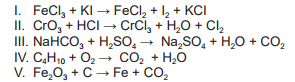
Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
O gráfico p = f( V ) a seguir representa uma série de transformações para um mol de um gás de comportamento ideal.
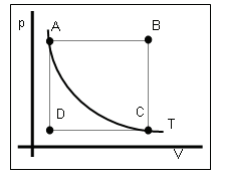
Identifique as transformações representadas por A→B, B→C, C→D, D→A e A→C e assinale a alternativa correta:
Ordene, de forma crescente, as forças de interação em:
I. Cristal de cloreto de sódio
II. Água pura
III. Acetona
IV. n-butano
V. Cloreto de sódio dissolvido em água
Agora assinale a alternativa que corresponde correta e respectivamente, à ordem crescente de força de interação das substâncias elencadas de I a V, anteriormente:
Utilizando a regra química de número de átomos de oxigênio menos o número de átomos de hidrogênio ionizáveis, assinale a alternativa que contém um ácido considerado forte: