Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço seja igual a 0,64, assinale a opção que indica a concentração de cloro gasoso presente no equilíbrio.
Leia o texto a seguir e resolva a questão:

Atualmente, medicamentos à base de sais de lítio (Li) vêm sendo empregados para o tratamento de casos de depressão em pacientes maníaco-depressivos. A respeito do elemento químico lítio e de suas espécies químicas, avalie as seguintes afirmativas:
I) Um átomo neutro de lítio com número de massa 7 possui 3 prótons, 3 elétrons e 4 nêutrons.
II) O íon Li1+ possui distribuição eletrônica semelhante à de um átomo neutro de berílio.
III) O átomo de lítio é o que possui o menor raio atômico dentre os metais alcalinos.
IV) O estabelecimento da ligação química entre um átomo de lítio e um átomo de cloro, no sal cloreto de lítio, dá-se por meio de uma ligação iônica.
V) O elemento químico lítio está localizado no grupo 2 e no período 1 da Tabela Periódica.
Das afirmativas feitas, estão corretas apenas
No estado sólido, o dióxido de carbono é conhecido como gelo seco. Em condições ambientes (25 ºC e 1 atm), ele passa do estado sólido para o estado de vapor. Acerca do dióxido de carbono, são feitas as seguintes afirmativas:
I – O dióxido de carbono é classificado como uma substância simples.
II – O dióxido de carbono é uma substância que sublima em condições ambientes.
III – A molécula do dióxido de carbono apresenta geometria angular.
IV – O dióxido de carbono é um óxido ácido que, em condições adequadas, pode reagir com água e produzir o ácido carbônico.
V – Quando se borbulha dióxido de carbono em uma solução aquosa de hidróxido de cálcio, sob condições adequadas, produz-se carbonato de cálcio e água.
VI – A hibridização do átomo de carbono na molécula do dióxido de carbono é sp2.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“Quando se efetuam duas substituições em um anel aromático, verifica-se experimentalmente que a posição da segunda substituição no anel depende da estrutura do primeiro grupo substituinte, ou seja, o primeiro ligante do anel determinará a posição preferencial para a outra substituição. Esse fenômeno recebe o nome de dirigência e existem somente dois tipos de dirigentes: ortoparadirigentes e metadirigentes.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 3: Química Orgânica. p. 318.
Considere a mononitração de um composto hipotético de fórmula C6H5X, em presença de ácido sulfúrico como catalisador. Esta mononitração pode gerar como produtos os compostos A, B e C, cuja reação é representada abaixo:
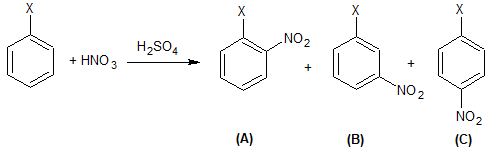
Acerca dessa reação e de seus compostos, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de condensação.
II – Caso X seja um haleto, os compostos A e C serão os produtos preferencialmente formados na reação.
III – Caso X seja o grupo metila (–CH3), o composto B será o produto preferencialmente formado na reação.
IV – Caso X seja o grupo nitro (–NO2), o composto B será o produto preferencialmente formado na reação.
V – Os compostos A, B e C são isômeros de função.
Das afirmativas feitas, estão corretas apenas
O arsênico foi o agente envenenador de escolha na Idade Média, tendo essa preferência se mantido até o início do século XX. Várias de suas características contribuíram, em grande parte, para essa popularidade: o aspecto inofensivo; a insipidez ou o sabor levemente adocicado, podendo ser facilmente misturado aos alimentos; a fácil obtenção; a evolução insidiosa dos sintomas de intoxicação, simulando doença; e a presença nos líquidos de embalsamamento – uma vez embalsamada a vítima, tornava-se impossível a prova do envenenamento.
GONTIJO, B. e BITTENCOURT, F. Anais Brasileiros de Dermatologia. 2005; 80(1):91-5. Adaptado.
Com relação às características eletrônicas do arsênico (número atômico 33), assinale (V) para a afirmativa verdadeira e (F) para a falsa.
( ) Possui elétrons distribuídos em três níveis eletrônicos.
( ) Seu elétron de maior energia ocupa o nível P.
( ) Possui cinco elétrons na camada de valência.
As afirmativas são, segundo a ordem apresentada, respectivamente,
A propagação do fogo em um incêndio depende da existência de três fatores: uma substância que possa ser queimada (combustível); uma substância que alimentará a combustão, chamada comburente (usualmente, o gás oxigênio); e um elemento deflagrador (chama, fagulha, descarga elétrica etc.). Na combustão completa de combustíveis orgânicos, como metano, propano, butano, etanol e metanol, há produção apenas de gás carbônico e água.
Dados: fórmulas moleculares: metano: CH4; propano: C3H8; butano: C4H10; etanol: C2H6O; e metanol: CH4O.
Considerando a reação de combustão completa desses combustíveis, o que necessitará de maior quantidade de gás oxigênio por molécula de combustível é o
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
Conforme o princípio de Le Châtelier, o rendimento desse processo pode ser aumentado
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
Durante o funcionamento dessa pilha, o
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
Com base nas informações e na figura apresentadas, é correto afirmar que os frascos identificados por A, B e C contêm, respectivamente, as soluções de
Nos Estados Unidos e em certos países da Europa, o uso do gás hilariante para aliviar as contrações do parto é bastante comum. No Brasil, o uso da substância para esse fim ainda é praticamente desconhecido.
“Gás hilariante” ou “gás do riso” é o nome popular do:
A figura a seguir mostra a série de desintegração radioativa natural do elemento tório (90Th232), um dos responsáveis pela radioatividade das areias monazíticas do Espírito Santo.
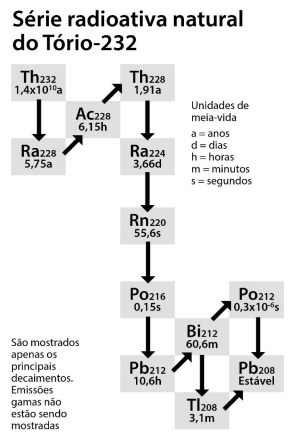
Considerando as informações da figura, pode-se afirmar corretamente que:
O elétron é uma partícula subatômica, com carga elétrica negativa representado pelos símbolos e− ou β−. Considera-se que os elétrons são partículas elementares, pertencentes a primeira geração da família dos léptons. A massa do elétron é aproximadamente 1/1836 da massa do próton (1 u). O elétron tem propriedades quânticas que incluem um momento angular intrínseco (spin) fracionário, o que significa que é um férmion e, portanto, dois elétrons não ocupam o mesmo estado quântico (princípio da exclusão de Pauli). Os elétrons podem ser descritos quanticamente por quatro números quânticos, assinale a alternativa que descreve estes quatro números quânticos.
Um ânion cloreto (Cl–) tem 17 prótons e 18 nêutrons e um cátion sódio (Na+) tem 11 prótons e 12 nêutrons. Quantos elétrons terão o Cl– e o Na+, respectivamente?
Assinale qual das alternativas apresenta um elemento da família dos não-metais que pode realizar quadro ligações covalentes para se estabilizar.

