Uma propriedade que é associada a líquidos é a capacidade de
molhar outras coisas. A molhabilidade é o espalhamento de um
líquido ao longo de uma superfície para formar uma película.
Para que a molhabilidade ocorra, as atrações no interior do
próprio líquido devem ser tão fracas a ponto de serem facilmente
suplantadas pela atração líquido-superfície.
Assinale a opção que indica, entre os líquidos, o que apresenta
maior molhabilidade.
O glifosato é um herbicida não seletivo (mata qualquer tipo de
planta) desenvolvido para matar ervas, principalmente perenes.
Seu efeito no organismo humano é cumulativo e a intensidade da
intoxicação depende do tempo de contato com o produto. O
herbicida pode continuar presente em alimentos num período de
até dois anos após o contato com o produto e em solos por mais
de três anos, dependendo do tipo de solo e clima.
Uma amostra de glifosato 5,07mg apresentou a seguinte
composição: 1,08mg de C; 0,24mg de H; 0,42mg de
N; 0,93mg de P e 2,4mg de O. A fórmula empírica dessa
substância é
Dados: Massa molar H=1g.mol–1 C=12g.mol–1 N=14g.mol–1
O = 16g.mol–1 P = 31g.mol–1
Para a reação 2 N2O5(g) → 4 NO2(g) + O2(g), a 298K, é 3,38x10–5s–1
Considerando a cinética desta reação, assinale V a afirmativa
verdadeira e F para a falsa.
( ) Espera-se um decaimento exponencial do reagente, uma vez que a lei de velocidade da reação pode ser expressa por v = k [N2O5].
( ) A reação segue a cinética de segunda ordem.
( ) Um catalisador apropriado poderá aumentar a velocidade da reação uma vez que diminui a diferença de energia livre de Gibbs da reação.
As afirmativas são, respectivamente,
Um resíduo pode ser classificado a partir das características de
seus constituintes. Os resíduos perigosos são classificados
considerando suas características de inflamabilidade,
corrosividade, reatividade e patogenicidade e recebem,
respectivamente os códigos D001, D002, D003 e D004
Os componentes presentes em grande quantidade em quatro
resíduos distintos, estão listados na tabela a seguir
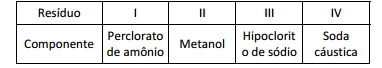
Os códigos relacionados a estes resíduos são:
O fluxograma a seguir sumariza os resultados obtidos por um
técnico na pesquisa de cátions do grupo I.
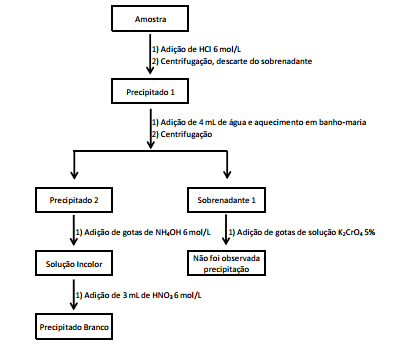
A análise deste fluxograma permite concluir que, na amostra,
possivelmente está presente o cátion
A acidez do vinho é expressa em termos da concentração de
ácido tartárico, cuja fórmula estrutural é representada abaixo.
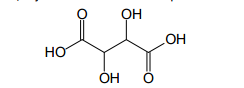
Para a determinação da acidez, 25,00mL de amostra de vinho
branco foram transferidos para Erlenmeyer. Adicionou-se 100mL
de água e gotas de fenolftaleína e titulou-se contra solução
padronizada de NaOH 0,100mol.L-1 Foram necessários 20,00mL
de solução da base na titulação.
A acidez da amostra (em unidades de gramas de ácido
tartárico/100mL) é:
Dado: Massa molar do ácido tartárico: 150g.mol-1
O pentafluoreto de fósforo é um composto reativo que se
apresenta como gás incolor em pressão e temperatura ambiente.
As configurações eletrônicas das camadas mais externas dos
átomos de Flúor e Fósforo são, respectivamente, 2s2 2p5 e 3s2
3p3. Assim sendo, a estrutura do PF5 apresenta
No preparo de uma solução tampão para ser utilizada em
culturas de bactérias, que exigem ambiente ácido, podem ser
usadas soluções de acetato de sódio 0,02 mol.L–1 e ácido acético
0,04 mol.L–1
O valor estimado para o pH dessa solução tampão é
Dados: pKa do ácido acético = 4,75 e log 2 = 0,30
Devido à sua reatividade, o fósforo não é encontrado na forma
elementar na natureza, porém forma parte de numerosos
minerais. A forma alotrópica branca pode ser obtida a partir do
aquecimento do fosfato de cálcio em um forno a 1450°C em
presença de sílica e carbono. O fosfato é reduzido a fósforo, que
se libera na forma de vapor.
2Ca3(PO4)2 + 6 SiO2 +10 C → 6CaSiO3 + 10 CO + P4
O fósforo branco obtido é, então, condensado em água, evitando-
se a presença de ar para que não inflame. O fósforo branco é
extremamente venenoso - uma dose de 52mg pode ser fatal.
A massa de Ca3(PO4)2 que deverá reagir para produção da dose
letal citada no texto é de :
Dados: Massa molar O = 16g.mol–1 P = 31g.mol–1 Ca = 40g.mol–1
O ácido glutâmico é um aminoácido não essencial, representado
pela fórmula a seguir.
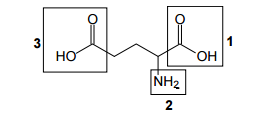
Os grupos destacados como 1, 2 (esse na forma NH3+) e
3 apresentam, respectivamente, valores de pKa iguais a 2,2; 9,6
e 4,2
Em pH igual a 6, as formas iônicas presentes correspondem à
O ácido hipocloroso é um ácido fraco, que pode ser utilizado
como princípio ativo de esterilização de meios de cultura. No
preparo de uma solução de ácido hipocloroso de pH 4 utiliza-se
uma solução deste ácido de concentração, em mol.L–1, próxima a:
Dado: pKa do HClO = 7
Uma amostra de água subterrânea, submetida a análise, revelou
a presença de íons Ca2+, Mg2+ e Ni2+, entre outros, nas seguintes
concentrações, em mol.L–1: [Ca2+] = 1,0 x 10–4; [Mg2+] = 1,6 x 10–3
e [Ni2+]=1,7 x 10–4 Com a adição progressiva de íons CO32–,ocorreram precipitações de sais.
Utilizando a tabela da constante do produto de solubilidade
desses sais,
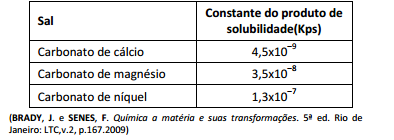
a ordem em que cada íon precipita é
Os ácidos graxos naturais possuem longas cadeias carbônicas,
normalmente não ramificadas com números pares de carbonos.
Os ácidos behénico (ácido docosanoico, C22H44O2), erúcico (ácido
cis-13-docosenoico, C22H42O2), brassídico (ácido trans-13-
docosenoico, C22H42O2) e oleico (ácido cis-9-ocatadecenoico,
C18H34O2) são exemplos de ácidos graxos de ocorrência natural,
cujas temperaturas de fusão estão relacionadas com suas
estruturas.
A ordem crescente das temperaturas de fusão destes compostos é
O teor de Ca2+ em amostra de urina foi determinado a partir das
seguintes etapas:
1- Precipitação do cátion por adição de excesso de solução
padrão de C2O42-
0,010 mol.L-1 a 5,00 mL de amostra de urina.
2- Lavagem do precipitado com água gelada para remoção do
oxalato livre e ressolubilização do sólido com solução ácida.
3- Titulação do H2C2O4 em solução utilizando solução padrão de
MnO
Após tratamento do precipitado, foram gastos 15,00 mL de
solução de MnO4- para a titulação do H2C2O4
A concentração de Ca2+ na amostra, em mol.L-1, é
Uma amostra de K2SO4 comercial, contaminada com KCl, foi
submetida a um ensaio gravimétrico para a determinação de sua
pureza. Assim, 1,148g da amostra foi dissolvido em água e
tratada com solução de Ba(NO3)2 O precipitado, após os cuidados
necessários, foi pesado sendo observada a massa 1,398g.
O teor de K2SO4 na amostra é
Dados: Massas molares K24 = 174g.mol–1 KCl= 74,5g.mol–1
BaSO4 = 233g.mol–1

