Considere os números atômicos dos seguintes elementos (escritos entre parênteses): oxigênio (8), Na (11), Mg (12), S (16) e Cl (17). Julgue as afirmativas a seguir, sobre os óxidos formados por estes elementos.
I – Aqueles com maior ponto de fusão são os óxidos de sódio e magnésio.
II – O enxofre forma mais de um óxido.
III – A ligação entre Mg e O é a que apresenta maior caráter iônico.
IV – O dióxido de cloro (ClO2) apresenta fórmulas de Lewis com híbridos de ressonância.
Está correto o que se afirma em
Julgue as afirmativas a seguir, sobre a fórmula do eugenol.
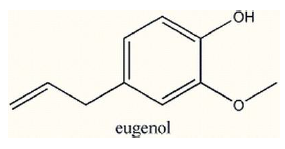
I- Apresenta as funções álcool e éter.
II- Seu hidrogênio ionizável é aquele ligado diretamente ao átomo de oxigênio.
III- Possui fórmula molecular C10H12O2.
IV- Há apenas forças de Van der Waals como forças intermoleculares.
V- Possui a função éster.
Está INCORRETO o que se afirma em
Leia atentamente o texto a seguir para responder à questão.

Contém expressão própria da linguagem informal o trecho
Segundo o regime jurídico dos servidores públicos civil da União, o servidor nomeado para cargo de provimento efetivo, ao entrar em exercício, ficará sujeito a estágio probatório, quando será observado, entre outros, o seguinte fator:
Nos termos da Lei nº 8.069/1990, que dispõe sobre o Estatuto da Criança e do Adolescente, um dos princípios da formação técnico-profissional é
Qual a diferença entre o tempo de meia vida de uma reação de primeira ordem e de segunda ordem?
De acordo com a equação química abaixo, considerando-se a constante dos gases como 0,082, o valor de Kp (constante de equilíbrio em termos de pressão parcial), quando Kc (constante de equilíbrio em termos de concentração) é igual a 8,5 à 300º C, será

O tamanho do íon depende de sua carga nuclear, número de elétrons e dos orbitais com elétrons de valência. De acordo com a afirmativa descrita, é correto afirmar que
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
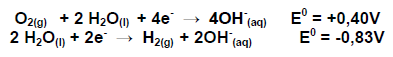
A reação global da pilha no estado padrão e seu valor do potencial padrão da pilha são, respectivamente,
A fórmula estrutural de um dos constituintes do jambu, erva típica da região Norte e muito apreciada na culinária paraense, é a seguinte:
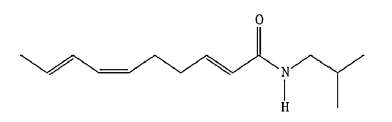
Sobre esta substância, faz-se as seguintes afirmativas:
I- possui a função amina,
II- apresenta 7 carbonos com hibridação sp²,
III- possui 23 átomos de hidrogênio,
IV- pode apresentar isomeria óptica,
V- apresenta a função amida.
Estão corretos os itens
Julgue as afirmativas a seguir, sobre o HCN.
I- Devido à eletronegatividade de seus elementos, possui geometria angular.
II- Sua base conjugada é o íon carboneto.
III- Trata-se de um composto covalente.
IV- Seu átomo de carbono tem hibridação sp3.
V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Ao adoçar 700 mL de suco de cupuaçu em uma jarra a 35 °C, uma pessoa utiliza 0,8 mols de glicose (C6H12O6), obtendo uma solução saturada sem corpo de fundo. Contudo, depois de ter colocado esta jarra em um refrigerador por duas horas, nota-se o acúmulo de uma certa quantidade de açúcar no fundo da jarra. Considerando que o coeficiente de solubilidade do açúcar no suco de cupuaçu é de 0,15 g/mL, e que as massas atômicas são C=12, H= 1 e O= 16, o número aproximado de mols de glicose não-dissolvidos a 0 °C é de
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente de polaridade dos compostos de I a V é
Uma alíquota de 15 mL de uma solução de Al(OH) 3 foi padronizada utilizando-se 0,15 miliequivalentes-grama de biftalato de potássio (hidrogenoftalato de potássio). Determinada a concentração da solução básica, 22 mL desta solução foram necessários para padronizar uma alíquota de 10 mL de H2SO4. Assim, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente:
Considerando-se que as massas molares em g.mol -1 são S=32, H= 1 e O= 16, a massa de H 2SO4 presente em 500 mL de solução é de, aproximadamente,
Leia atentamente o texto a seguir para responder à questão.

A regência verbal culta NÃO foi observada em

