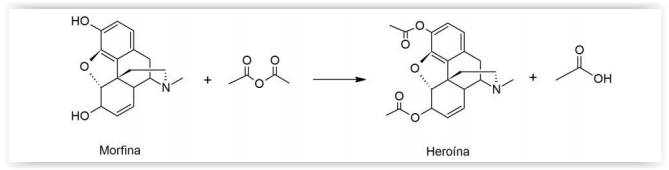
A morfina é um derivado do ópio, utilizado desde o século XIX como anestésico em campos de batalha e graves doenças
terminais. O derivado mais famoso desse alcaloide é a heroína, obtida pela acetilação da morfina com anidrido acético,
como ilustrado pela seguinte reação não balanceada:
De acordo com a reação acima, quantos mols de anidrido acético são necessários para acetilar totalmente 2 mols de
morfina?
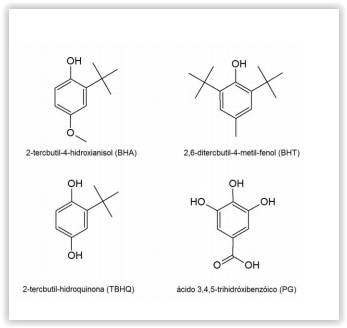
Compostos fenólicos são utilizados como antioxidantes em
alimentos, cosméticos e combustíveis, porém seu uso pode
ser limitado pela solubilidade dessas substâncIas nos
produtos de aplicação. As estruturas de alguns antioxidantes
fenólicos mais usados são mostradas ao lado:
Em relação à polaridade das substâncIas apresentadas,
assinale a alternativa que apresenta a ordem crescente de
solubilidade desses compostos em óleos vegetais
(triglicerídeos).
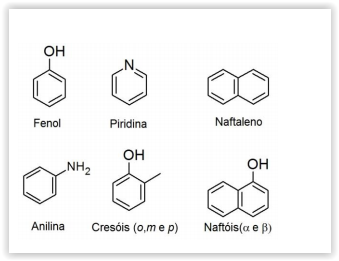
Antes da era do petróleo, compostos aromáticos eram obtidos
pela destilação do alcatrão de hulha, o que possibilitou o grande
desenvolvimento da indústrIa de corantes no século XIX. Nessa
destilação, frações obtidas entre 160 e 270 °C (óleos médios e
pesados) contêm principalmente as substâncIas ao lado:
Uma separação posterior pode ser realizada levando-se em conta
o comportamento de solubilidade dessas substâncIas e também
a sua reatividade diferencIada. Em um experimento, a mistura
desses seis compostos foi solubilizada em hexano. A solução
resultante foi transferida para um funil de separação e submetida
às etapas operacionais detalhadas a seguir:
Etapa I) Solução hexânica foi extraída eficientemente com
solução aquosa de HCl 10% e a solução ácida separada foi
neutralizada com solução aquosa de NaOH 10%, que, após
tratamento adequado, gerou a Fração A.
Etapa II) Solução hexânica resultante da Etapa I foi extraída
eficientemente com solução aquosa de NaOH 10% e a solução alcalina separada foi neutralizada com solução aquosa de
HCl 10%, que, após tratamento adequado, gerou a Fração B.
Após a realização das duas etapas subsequentes, a fração hexânica residual foi denominada Fração C.
Com base nessas informações, assinale em qual fração (A, B ou C) se encontra cada composto:
( ) Fenol.
( ) Piridina.
( ) Naftaleno.
( ) Anilina.
( ) Cresóis.
( ) Naftóis.
Assinale a alternativa que apresenta a sequêncIa correta, de cima para baixo.
Foi realizada uma aula experimental visando a síntese de uma amida aromática, a acetanilida (ou N-fenil-acetamida), de
acordo com o pr°Cedimento experimental resumidamente descrito a seguir:
Em um béquer limpo e seco, misturar o ácido acético glacIal e o acetato de sódio anidro. Adicionar a anilina e, em seguida, o
anidrido acético. Após 10 minutos de reação, verter o meio reacional sobre água destilada gelada, sob agitação. A acetanilida
precipita. Filtrar em funil de Büchner e lavar o produto bruto com água destilada gelada até pH neutro. Purificar a acetanilida por
recristalização usando água quente e carvão ativado.
Sobre esse pr°Cedimento, considere as seguintes afirmativas:
1- A reação envolvida na síntese da acetanilida é uma reação de acilação.
2- Foi utilizada água gelada na etapa de precipitação da acetanilida bruta para reduzir as perdas de produto por
solubilidade em água.
3- A purificação do produto bruto foi realizada em água quente porque a acetanilida é mais solúvel em água quente que
em água frIa.
4- O carvão ativado foi utilizado para acelerar a precipitação da acetanilida.
Assinale a alternativa correta.
Alguns pr°Cessos de obtenção de H2SO4 utilizam pirita (FeS2) como matérIa-prima no lugar de enxofre elementar (S8).
Esses pr°Cessos podem ser descritos resumidamente pelas seguintes equações, nas quais se pode notar varIações no
estado de oxidação do enxofre:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
De acordo com o texto, assinale a alternativa que apresenta os estados de oxidação do enxofre nas espécies FeS2, SO2,
SO3 e H2SO4, respectivamente.
A queima de enxofre elementar gera compostos gasosos responsáveis pela formação da chuva ácida, com consequente
deterioração de edificações e de monumentos construídos em mármore, acompanhada de liberação de gás carbônico na
atmosfera. Esse pr°Cesso pode ser ilustrado pelas seguintes reações não balanceadas:
S + O2 → SO2
SO2 + O2 → SO3
SO3 + H2O → H2SO4
H2SO4 + CaCO3 → CaSO4 + H2CO3
H2CO3 → CO2 + H2O
Considerando essa sequêncIa de eventos, assinale a alternativa que apresenta a equação global balanceada dos eventos
supracitados.
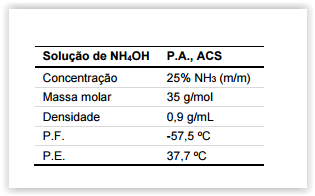
Foi requisitado a um técnico de laboratório que preparasse uma
solução de hidróxido de amônio, a partir de uma solução comercIal
concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
Assinale a alternativa que indica o volume aproximado da solução
comercIal (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
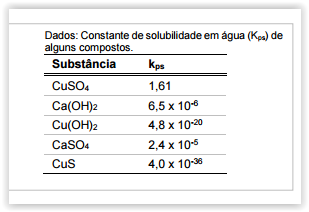
A calda bordalesa, muito utilizada como fungicida na agricultura, é
preparada pela mistura de sulfato de cobre pentaidratado
(CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em
proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma
suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a
alternativa que apresenta o constituinte principal do sólido suspenso
na calda bordalesa.
O índice de acidez (Ia ) de óleos e gorduras é um dos parâmetros para a determinação de sua qualidade, visto que, quanto maior o grau de decomposição dos lipídeos, mais alta é sua acidez. Na determinação do Ia, uma quantidade conhecida de amostra (mA ) é dissolvida num solvente aproprIado (p.e. etanol) e titulada com uma solução padronizada de NaOH de concentração CB, utilizando-se fenolftaleína como indicador. Sabendo que o Ia é definido como a massa de KOH (em miligramas) necessárIa para neutralizar 1 grama de amostra, dado pela equação Ia = mKOH(mg) / mA(g ), e que o volume de solução de NaOH utilizado na titulação é VB, assinale a alternativa que apresenta a expressão para o cálculo do Ia, de acordo com os dados obtidos experimentalmente. Dados: massa molar do KOH = 56,1 g/mol
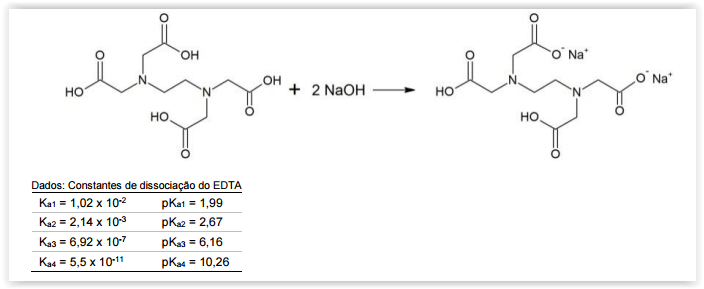
O ácido etilenodIamino tetra-acético (EDTA) é usado como “sequestrante" em detergentes, impedindo a precipitação do
surfactante (princípio ativo) pelos íons Ca+2, Mg+2 e Fe+3 presentes na água. Em análise química, o EDTA é utilizado como
titulante para a determinação de dureza (Ca+2, Mg+2) de águas, cujo sal dissódico é obtido pela seguinte reação:
De acordo com a reação de neutralização parcIal do EDTA acima apresentada, assinale a alternativa que apresenta o
intervalo de pH no qual é obtido apenas o sal dissódico.
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são
também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram col°Cadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
As atividades realizadas nos laboratórios didáticos de Química precisam ser acompanhadas do descarte correto dos
resíduos produzidos durante as aulas experimentais, sendo importante classificar os resíduos e escolher o tratamento
mais adequado. Nesse sentido, numere a coluna da direita de acordo com sua correspondêncIa com a coluna da esquerda.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
Artefatos de aço inoxidável são resistentes à corrosão devido a um fenômeno conhecido como passivação, que é a
formação de uma fina camada de óxido de cromo na superfície, por ação do ar ou de oxidantes químicos. Sabendo-se que
o ácido nítrico (HNO3) na concentração de 1,6 mol/L pode ser usado como agente passivante, qual volume de HNO3
concentrado (em litros) deve ser utilizado para a obtenção de 100 L de solução passivante?
(Dados: MM(HNO3) = 63,0 g/mol; HNO3 concentrado: d = 1,40 g/mL; teor máximo = 65%(m/m))
Na determinação de cálcio em águas naturais, a AOAC (Ass°CIation of OfficIal Analytical Chemists/USA) recomenda um
método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e,
em seguida, adicionar a quantidade necessárIa de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a
massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser
expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma
amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4-2(aq.) → CaC2O4(s)CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol;
densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
O ácido fosfórico (H3PO4) de alta pureza é obtido por vIa seca ou térmica, pela combustão do fósforo elementar e posterior
hidratação do P2O5, de acordo com as reações abaixo:
Nesse pr°Cesso, de acordo com as equações acima, assinale a alternativa que apresenta a quantidade de calor liberado
na formação do H3PO4 (em kcal/mol).