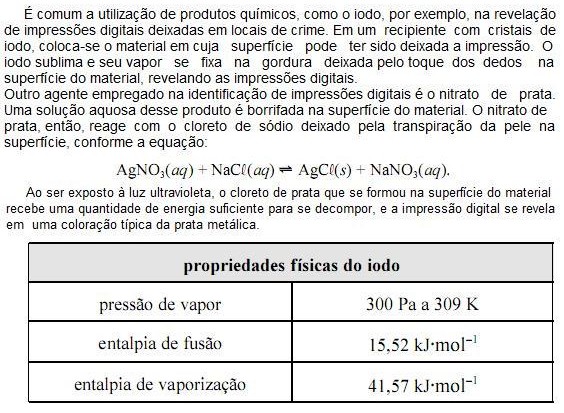
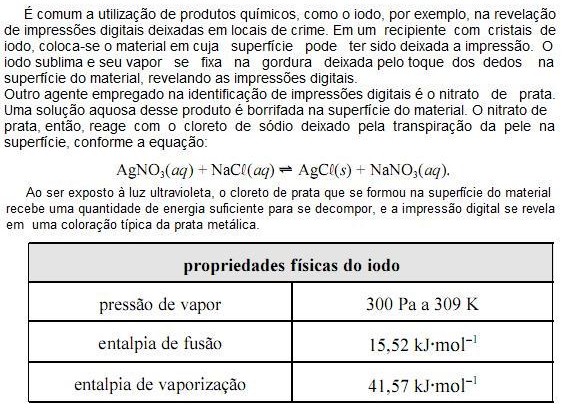
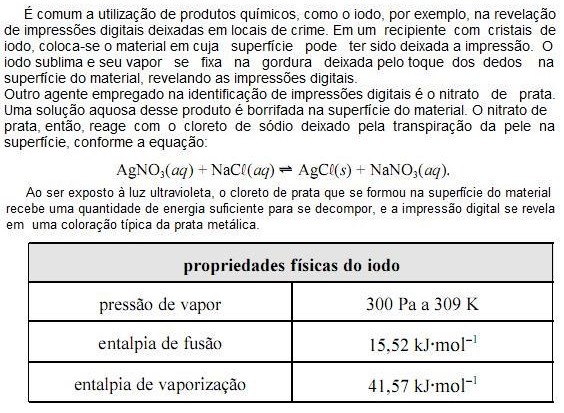
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
A constante de equilíbrio da reação entre o nitrato de prata e o cloreto de sódio, referida no texto, é menor que 1.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
A decantação é o método mais indicado para a separação do cloreto de potássio da solução injetada.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 molL1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Considerando-se a reação ilustrada abaixo, correspondente à síntese do tiopental, em que Et refere-se ao grupo etil, é correto concluir que a síntese dessa molécula se inicia com uma alquilação em uma molécula pertencente ao grupo éster.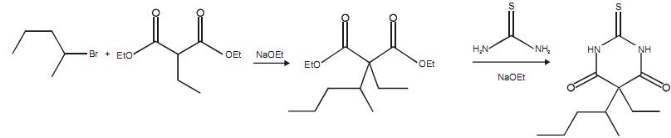
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 mol1
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Considerando-se a estrutura do íon pancurônio, apresentada a seguir, é correto afirmar que essa molécula é formada por cinco anéis aromáticos.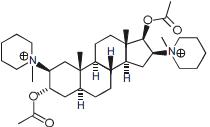
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
A ligação existente entre os íons do nitrato de amônio sólido é direcional, daí a elevada resistência desse tipo de sólido a impactos.
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
A partir das informações do texto, é correto concluir que a reação AgCL(s) ? Ag(s) + ½ CL2(g) é catalisada por luz ultravioleta.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Sabendo-se que o sódio e o cloro estão no mesmo período da Tabela Periódica e que o sódio pertence ao grupo 1 e o cloro, ao grupo 17, é correto concluir que a energia de ionização do cloro é superior à do sódio.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
A eventual dissolução de nitrato de amônio em água causaria a diminuição do pH da água.