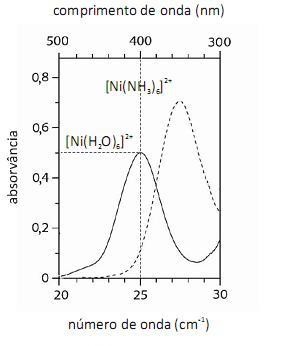

De acordo com a lei de Beer, infere-se do espectro do complexo 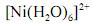 que, para uma radiação com comprimento de onda igual a 400 nm, a absortividade molar é maior que
que, para uma radiação com comprimento de onda igual a 400 nm, a absortividade molar é maior que 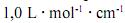 .
.
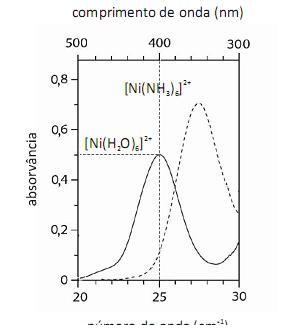

A análise espectroscópica do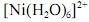 mostra que a razão entre o número de fótons com comprimento de onda igual a 400 nm que atinge o transdutor e o número desses fótons que atinge a amostra é maior do que 0,40.
mostra que a razão entre o número de fótons com comprimento de onda igual a 400 nm que atinge o transdutor e o número desses fótons que atinge a amostra é maior do que 0,40.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
A constante de equilíbrio K pode ser calculada por meio da expressão K = 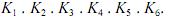
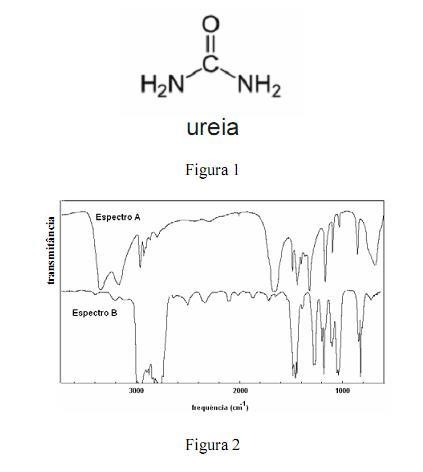
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A reação da amônia com a propanona resulta na formação da etanamida.
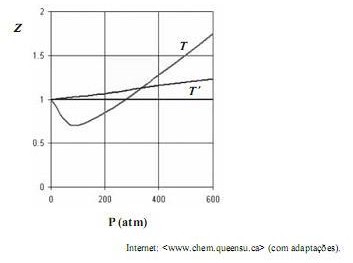
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o 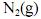 em duas temperaturas distintas (T e T'), julgue os itens subsequentes.
em duas temperaturas distintas (T e T'), julgue os itens subsequentes.
A temperatura T é superior à temperatura T.
A massa, em gramas, de uma amostra de NaC. foi medida usando-se cinco balanças analíticas. Devido a problemas com a calibração dessas balanças, os resultados obtidos foram ligeiramente diferentes, como os apresentados abaixo. A medida com o maior número de algarismos significativos é
Um avião está em voo retilíneo horizontal. Ao percorrer uma distância AB em 10 segundos, a sua velocidade aumenta de 350 km/h em A para 422 km/h em B.
No referido trecho, a aceleração média do avião, em m/s2, é
A 1,0 L de solução de nitrato de prata 1 M, adicionaram-se 146,0 g de ácido clorídrico (329 mL de solução com 37% de HC. em peso), completando-se com água até um volume final de 2,0 L.
Qual o teor residual de prata na solução?
Um termômetro mede temperaturas em graus Celsius (oC), e um segundo termômetro mede temperaturas em uma escala que chamaremos Efe (0F). Temos: 0 0C = 32 oF e 10 0C = 50 0F.
A temperatura de -40 0C corresponde a quantos graus na escala do segundo termômetro?
A estrutura apresentada abaixo é da amoxicilina, antibiótico muito utilizado no tratamento de infecções causadas por
bactérias.
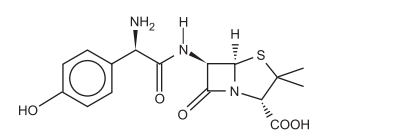
Na estrutura da amoxicilina estão presentes, entre outras, as seguintes funções orgânicas:
A presença de um alceno pode ser facilmente confirmada através do teste de Baeyer. Nesse teste, utiliza-se solução
diluída de permanganato de potássio em meio neutro ou levemente alcalino, e o descoramento da coloração violeta indica
a presença do alceno.
Nesse teste, o produto da reação é um(a)
Na nitração da acetanilida, utiliza-se ácido nítrico em
presença de ácido sulfúrico concentrado, conforme
mostrado no esquema abaixo.
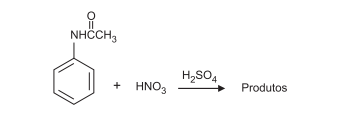
Nessa reação, a(o)
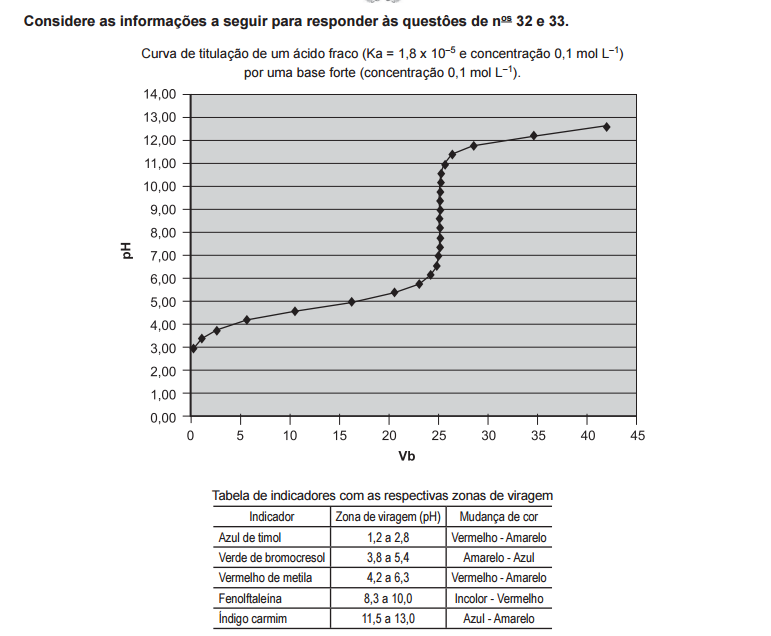
Adicionando-se 45 mL de solução de base forte a 25 mL da solução de ácido fraco, e levando-se o volume a 200 mL, com água destilada, o pH da solução resultante será, aproximadamente,
Propriedades coligativas são aquelas que dependem do
número de partículas (espécies químicas) dissolvidas.
Assim, se 3,42 g de sulfato de alumínio forem totalmente
solubilizados em 1,00 L de água, e o grau de dissociação
do soluto for igual a 98,0%, a quantidade máxima de
partículas dissolvidas na água será, aproximadamente,
Dados:
M(A2(SO4)3) = 342 g mol-1
Constante de Avogadro = 6 x 1023
Uma amostra de 15,0 g de bronze (liga metálica de cobre
e estanho) foi completamente dissolvida com ácido nítrico
concentrado, resultando em 1,00 L de solução aquosa.
Um volume de 0,500 L dessa solução foi misturado com
excesso de ferrocianeto de potássio, também em solução,
formando 17,0 g de um precipitado de ferrocianeto de cobre,
conforme a reação apresentada a seguir.
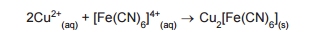
Sabendo-se que o Sn2+ não forma produto sólido com
o íon ferrocianeto, sendo apenas um íon espectador, a
massa de cobre, em g, presente na amostra de bronze é,
aproximadamente
Dados: M(Cu2 [Fe(CN)6 ] (s)) = 339 g mol-1 M(Cu) = 63,5 g mol-1