A quantidade máxima, em g, de hidróxido de chumbo produzida ao se misturar 1.000 mL de uma solução de cloreto de chumbo (PbCl2) 0,10 mol/L e 50 mL de uma solução de hidróxido de sódio (densidade 1,1 g/mL e 11% de NaOH em massa) é, aproximadamente, Dado: Considere a reação completa M(Pb(OH)2) =241 g mol-1
A separação cromatográfica de duas substâncias é feita usando fase estacionária apolar e fase móvel polar de composição constante (água/propanol 40/60% v/v). Nessas condições, a substância M aparece com tempo de retenção 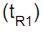 igual a 10,2 min, enquanto o tempo de retenção
igual a 10,2 min, enquanto o tempo de retenção 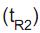 da substância N é 15,2 min.
da substância N é 15,2 min.
A respeito desse procedimento de separação, afirma-se que a(o)

O complexo de Fe(II) com 1,10-fenantrolina tem seu máximo de absorção em 510 nm. Nesse comprimento de onda, foram obtidas as absorvâncias de quatro diferentes soluções padrões de Fe(II) preparadas em excesso de 1,10-fenantrolina (ver na tabela acima as absorvâncias já corrigidas pelo valor do branco).
A partir desses dados, conclui-se que
Em análise gravimétrica direta, o produto sólido deve ser bem formado para permitir a sua separação quantitativa da fase líquida e posterior medição da massa. No entanto, dependendo das condições do experimento, pode haver formação de suspensão coloidal. Na análise gravimétrica,
Na potenciometria, o eletrodo indicador é aquele sensível à variação da atividade (que guarda relação com a concentração) da espécie química de interesse.
Um eletrodo que NÃO pode ser usado como indicador em potenciometria é o
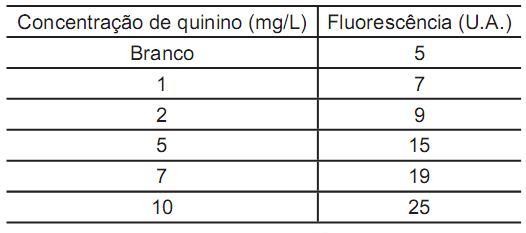
A inclinação de uma curva de calibração (curva analítica), mais conhecida como sua sensibilidade (m), é um parâmetro indicador da capacidade do método analítico em discriminar duas quantidades diferentes de um mesmo analito. Acima, estão tabelados os resultados em uma curva de calibração que relaciona fluorescência de quinino (em unidades arbitrárias de fluorescência - U.A.) e a concentração de quinino, em mg/L, em uma amostra de água tônica.
O valor da sensibilidade da curva analítica, em U.A. L/mg, é, aproximadamente,
Na temperatura ambiente, cloreto de sódio e sulfato de potássio são sais que, dissolvidos em água, liberam íons que não se hidrolisam. Acetato de potássio, bicarbonato de sódio e cloreto de amônio são sais que liberam íons quando dissolvidos em água; desses, há os que se hidrolisam e os que não se hidrolisam.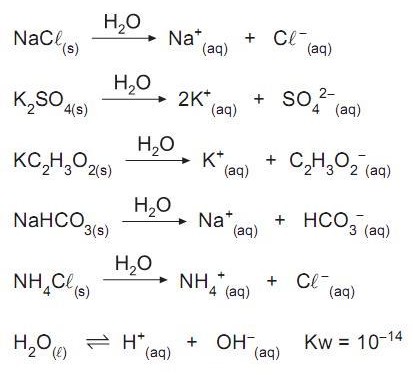
Considerando os íons dos sais que reagem com a água (hidrólise) e os que não reagem, afirma-se que a solução aquosa de
Um técnico recebeu a incumbência de preparar solução aquosa de 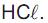 a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de
a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de 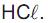
O volume da solução contida no frasco recém-adquirido que deve ser transferido para um cilindro graduado, visando ao preparo de 1,0 L de solução aquosa 0,15 mol L-1 , é
A corrosão é resultado da ação do meio sobre um determinado material, causando sua deterioração. A formação da ferrugem se caracteriza por ser um processo de corrosão do ferro, onde os átomos de ferro sofrem oxidação, perdendo elétrons. A aplicação de uma camada de outro metal sobre o ferro o protege da oxidação.
Considere as reações de redução e os respectivos potenciais apresentados a seguir.
O elemento que seria útil para a proteção do ferro é o
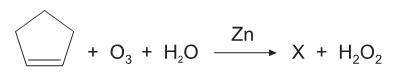
A reação de oxidação pelo ozônio 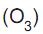 seguida de hidratação é chamada de ozonólise. Nessa reação, adiciona-se zinco em pó, com intuito de consumir o peróxido de hidrogênio formado. A equação química acima representa a ozonólise do ciclopenteno formando a substância aqui denominada como X.
seguida de hidratação é chamada de ozonólise. Nessa reação, adiciona-se zinco em pó, com intuito de consumir o peróxido de hidrogênio formado. A equação química acima representa a ozonólise do ciclopenteno formando a substância aqui denominada como X.
Sobre a reação e a substância X, conclui-se que a(o)
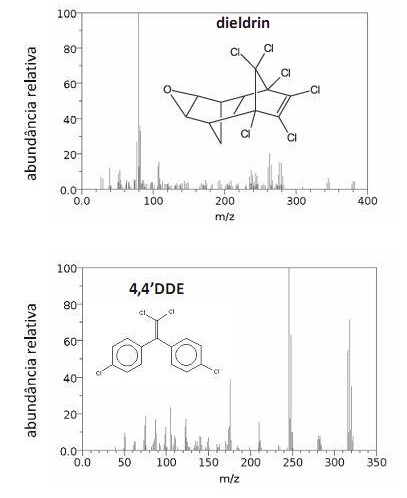
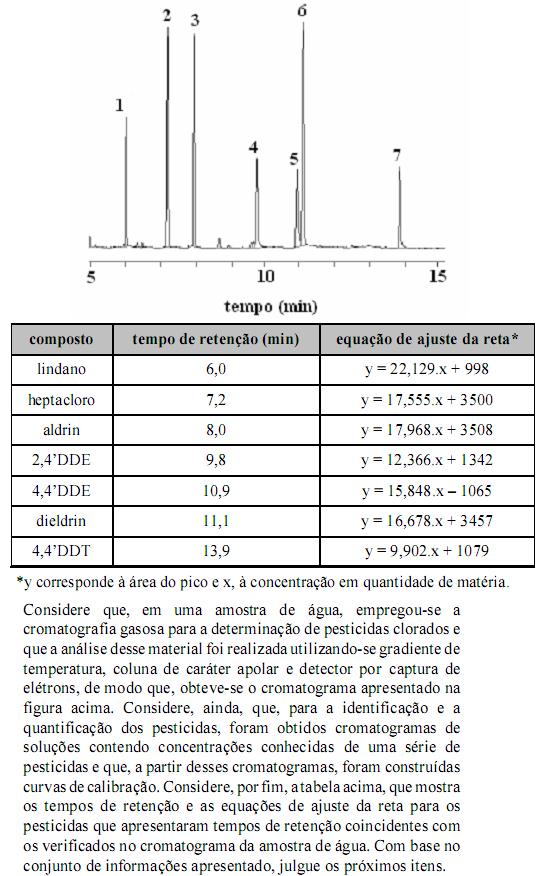
Os espectros de massa mostrados acima são, respectivamente, do dieldrin e do 4,4DDE, compostos que usualmente têm seus picos parcialmente sobrepostos em cromatogramas. Considere, ainda, que o elemento cloro apresenta massa molar igual a 35,5 g/mol e apenas dois isótopos, com números de massa iguais a 35 e 37. A partir dessas informações, julgue os itens que se seguem.
No espectro de massa do 4,4DDE, o pico em m/z igual a 116 corresponde a um íon molecular do composto.
Considerando-se a fase estacionária da coluna utilizada, é correto afirmar que o composto correspondente ao pico 7 apresenta maior ponto de ebulição que o composto correspondente ao pico 1.
A extração com solvente apolar ou de baixa polaridade consiste em uma técnica eficiente para a extração de compostos orgânicos a partir de soluções aquosas. Define-se o coeficiente de partição (K) como a razão entre as concentrações do composto no solvente orgânico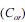 e na fase aquosa
e na fase aquosa 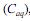 , quando atingido o
, quando atingido o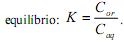
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
A fração do composto extraída pelo estudante B será maior que a extraída pelo estudante A.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam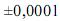 g, para uma simples leitura na balança utilizada,
g, para uma simples leitura na balança utilizada,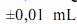 e , para uma leitura de menisco no balão, julgue os próximos itens.
e , para uma leitura de menisco no balão, julgue os próximos itens.
Caso a solução de biftalato preparada seja usada, posteriormente, na padronização de uma solução básica, a presença de impurezas no biftalato usado para a preparação de sua solução gerará um erro aleatório que, consequentemente, afetará a precisão dos resultados obtidos durante a padronização.
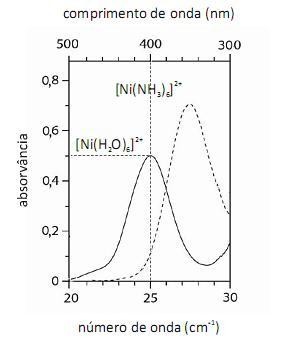

O fato de os espectros acima apresentarem largas bandas de absorção, em vez de linhas ou picos estreitos, demonstra que o equipamento utilizado não possuía monocromador.