Considere as Cartas de Controle apresentadas a seguir:
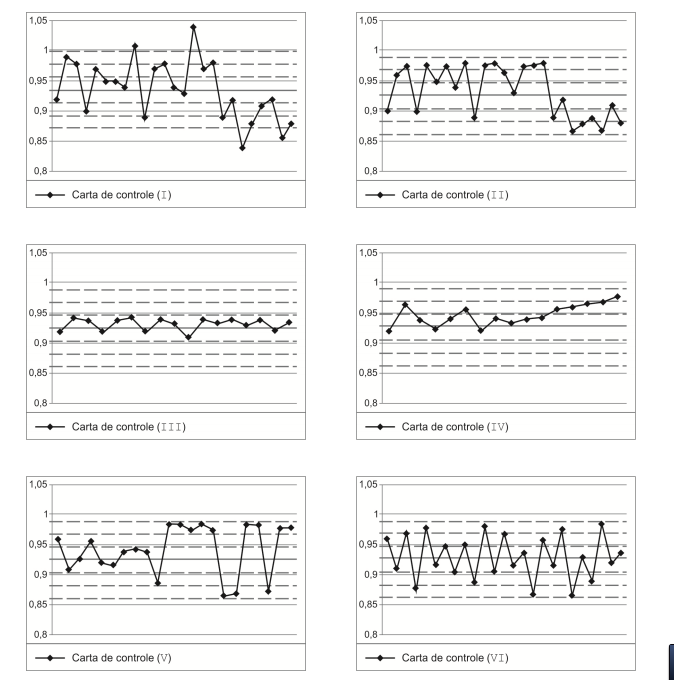
Analisando as Cartas de Controle é correto afirmar que:
Sobre os ácidos inorgânicos, assinale a afirmativa INCORRETA.
Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) O potencial de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
Para facilitar o trabalho dos químicos, os compostos químicos foram dividos em diversas classes ou funções. Duas funções importantíssimas são os ácidos e as bases. Historicamente, os conceitos que definem os ácidos e as bases mudaram conforme a evolução dos conceitos e o entendimento da química. Diante do exposto, analise as afirmativas.
I. O sueco Svante Arrhenius recebeu o Prêmio Nobel de Química devido aos seus trabalhos de dissociação eletrolítica. Dentro destas teorias, tem‐se as seguintes definições: “ácido é toda substância química que, em água, libera como cátion exclusivamente íons H+” e “base é toda substância química que, em água, libera como ânions exclusivamente íons H+”. Trata‐se da teoria iônica.
II. Em 1923, Johannes Nicolaus Bronsted e Thomas Martin Lowry propuseram, independente, a teoria ácido‐base de Bronsted‐Lowry. Para eles, “ácido é toda substância que libera íons H+” e “base é toda substância que recebe (ou aceita) íons H+”. Trata‐se da teoria protônica.
III. Gilbert Newton Lewis, em 1916, foi um dos grandes responsáveis pelas explicações adequadas sobre as ligações covalentes, a partir do estudo do comportamento dos elétrons. Para Lewis, “ácido é toda substância capaz de aceitar (ou receber pares de elétrons) pares de elétrons de outra substância” e “base é toda substância capaz de doar (ou ceder pares de elétrons) pares de elétrons para outra substância”. Trata‐se da teoria eletrônica.
Está(ão) correta(s) a(s) afirmativa(s)
Uma das etapas do tratamento das águas para consumo residencial consiste na adição sulfato de alumínio e hidróxido de cálcio, essa etapa é conhecida como floculação, pois forma “flocos” gelatinosos insolúveis em água que vão “agarrando” as partículas que estão sendo arrastadas pela água.
Abaixo é mostrada a reação entre essas duas substâncias.
AI2(SO4)3 + 3 Ca(OH)2 → 2 AI(OH)3 + 3 CaSO4
Como pode ser classificada essa reação?
Qual meio de cultura contém nutrientes que favorecem o crescimento livre de diversos fungos duriformes e filamentosos, sendo utilizado para o cultivo e crescimento de espécies de Candidas e fungos filamentosos, particularmente associados às infecções superficiais?
Sabe-se que 10 mL da solução inicial com concentração igual a 2 mol/L foi transferida para um balão volumétrico de 50 mL e o volume foi completado com água destilada. Qual a concentração final da solução de HCL?
O pH resultante da mistura de 10 mL de um ácido fraco, como o ácido acético, com 10 mL de uma base forte, como o hidróxido de sódio, ambos com a mesma concentração – 0,1 mol/L –, é
Para determinar a concentração de uma solução de ácido clorídrico solução do ácido foi titulada com hidróxido de sódio 0,1 mol/L e o ponto final determinado quando 20 mL de base havia sido gasta. Qual era a concentração de ácido clorídrico?
Qual dos compostos a seguir é uma base?
No espectrômetro de massas, após a amostra ser injetada, as moléculas da amostra devem ser transformadas em partículas carregadas pela fonte de ionização antes de serem analisadas e detectadas. Qual o método de ionização em que a amostra a ser analisada é dissolvida ou dispersa em uma matriz e colocada em um caminho de um feixe de íons de energia alta?
Analise os compostos.

Os compostos que podem atuar como ligantes são apenas os das alternativas
Atualmente, veículos automotores brasileiros podem ser abastecidos tanto com etanol, quanto com gasolina. Considere que:
1.essas substâncias estão puras na bomba de combustível;
2.a gasolina é constituída apenas de octano;
3.a densidade dessas substâncias são: etanol = 805 g/L e octano = 756 g/L;
4.os ΔH das seguintes reações são:

É correto afirmar que a relação aproximada de energia liberada, quando comparada à queima de 40 L de gasolina e 40
L de etanol (ΔHgasolina/ΔHetanol), é
Qual será a equação matemática que representa a velocidade de transformação da seguinte reação? (Considere todos os compostos como gasosos.)
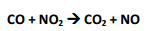
A equação química correta, que descreve a transformação relatada na anotação 2 é escrita como


