O esquema e a equação global representados a seguir referem-se
à eletrólise de uma solução aquosa de iodeto de
potássio, na concentração de 0,1 mol/L, usando eletrodos de
grafite.

Com base nessas informações, afirma-se que na eletrólise de
iodeto de potássio aquoso
Considere a necessidade de consumo diário de um volume V de gás natural de uma cidade, distante D quilômetros por via marítima do ponto de produção do gás. Analisando a influência de V e D no modal de distribuição, o modal escolhido seria, tipicamente, o modal
Sejam as propriedades massa (M), índice de Wobbe (Wo), e poder calorífico superior (P ) (este último em kJ/m3 ); e os subscritos DEST representando destino e ORIG, origem. No transporte do GNL por navios, o não isolamento total leva à vaporização e à perda de certa quantidade de material. Sendo o GNL composto por uma mistura de hidrocarbonetos, admitindo-se que a densidade não sofra variações muito significativas, a carga líquida que chega ao destino apresenta
A teoria do orbital molecular descreve os elétrons na molécula, usando funções de onda
específicas, chamadas orbitais moleculares.
São regras que descrevem a formação dos Orbitais Moleculares (OM) e como eles são
ocupados pelos elétrons, EXCETO:
Uma solução contendo KMnO4 e H2SO4 é despejada em uma proveta; e uma solução de
FeSO4 é despejada em outra. Uma ponte salina é usada para unir as provetas. Uma
lâmina de platina é colocada em cada solução e as duas soluções são conectadas por um
fio que passa por um voltímetro.
Analise as afirmações que foram feitas a partir da pilha obtida.
I. A soma dos menores números inteiros dos coeficientes estequiométricos da equação
balanceada da reação global é 24.
II. A semireação do anodo ocorre no ferro e do catodo no manganês.
III. A representação da célula voltaica da reação de oxirredução é
Fe2+(aq)/Fe3+(aq) ?? Mn7+(aq) / Mn2+(aq).
A partir dessa análise, conclui–se que estão CORRETAS as afirmativas
O cloreto de alumínio anidro é obtido a partir da seguinte reação:
2Al(s) + 3Cl2(g) → 2AlCl3M(s)
Observe as seguintes equações.
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g) ΔH0= –1.049 kJ
HCl(g) → HCl(aq) ΔH0= –74,8 kJ
H2(g) + Cl2(g) → 2HCl(g) ΔH0= –185 kJ
AlCl3(s) → AlCl3(aq) ΔH0= –323 kJ
Considerando–se as equações acima, é CORRETO afirmar que a entalpia de reação da
formação do cloreto de alumínio anidro é igual a
A síntese do amoníaco, também designada por síntese de Haber, refere–se a um
processo hoje largamente empregado em escala industrial em que os parâmetros que
interferem na reação química entre nitrogênio e hidrogênio são idealmente ajustados, a
fim de maximizar a síntese do amoníaco.
Sobre a produção de amônia pelo processo Haber, assinale com V as afirmativas
verdadeiras e com F as falsas.
( ) A velocidade de desaparecimento do gás nitrogênio é um terço vezes a velocidade
de desaparecimento do gás hidrogênio.
( ) A velocidade de formação da amônia é duas vezes a velocidade de
desaparecimento de gás hidrogênio.
( ) A velocidade de formação da amônia é dois terços vezes a velocidade de
decomposição do gás nitrogênio.
( ) O processo de formação da amônia a partir de gás nitrogênio e gás hidrogênio é
exotérmico.
Assinale a alternativa que apresenta a sequência CORRETA.
Um dos princípios ativos dos medicamentos indicados para o tratamento da dor, da tosse
e no combate à diarreia é a codeína, um derivado da morfina, princípio ativo extraído da
papoula, sendo o ópio conhecido desde a época dos sumérios há 4.000 anos a.C.
A figura abaixo mostra a estrutura da codeína.
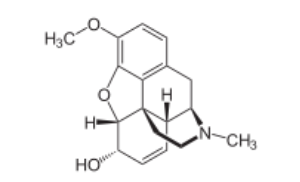
Sobre a estrutura da codeína, assinale a alternativa INCORRETA.
Um químico precisou preparar uma solução de HCl em um balão volumétrico de 100 mL.
Ele utilizou uma solução estoque com as seguintes especificações no rótulo:
Porcentagem em massa por volume do HCl = 38% m/v
Densidade da solução = 1,2 g/mL
Massa molar do HCl = 36,5 g/mol
Considerando–se as informações citadas, é CORRETO afirmar que o volume aproximado
extraído da solução estoque utilizado para preparar a solução de 0,5 mol/L de HCl é
Para remover as impurezas grossas na produção do álcool, o caldo é inicialmente
peneirado e, em seguida, tratado com agentes químicos, para coagular parte da matéria
coloidal, precipitar certas impurezas e modificar o pH.
Com relação aos métodos utilizados no processo de clarificação do caldo da cana–deaçúcar
é INCORRETO afirmar que
Um modo de aumentar a velocidade de uma reação é usar um catalisador, uma
substância que aumenta a velocidade da reação química.
Sobre os catalisadores, é INCORRETO afirmar que
Durante os processos de produção do álcool, são gerados resíduos que, quando não
reutilizados, podem causar impactos ambientais. Entre esses resíduos, estão: bagaço,
torta de filtro, vinhaça, levedura seca e óleo fusel.
Sobre os resíduos resultantes dos sistemas de produção do álcool, avalie as afirmações
que se seguem.
I. O bagaço é um resíduo fibroso que pode ser utilizado como combustível nas caldeiras
para geração de energia elétrica e calor, mas também pode ser utilizado na
fabricação de papeis e como ração animal, se for hidrolisado.
II. A vinhaça é um resíduo resultante de destilação do álcool que é utilizado,
principalmente, na lavoura para irrigação da cana, na chamada fertirrigação.
III. O óleo fusel é resultante da destilação do álcool que é utilizado nas indústrias
químicas e indústrias de cosméticos.
Assinale a alternativa que apresenta a sequência CORRETA.
Considere uma titulação de 25,0 mL de uma solução 0,100 mol/L de FeSO4 com uma
solução de 0,100 mol/L de Ce4+ em meio ácido, feita na temperatura de 25 ºC. As semireações
abaixo mostram os potenciais padrões de redução do cério e ferro,
respectivamente.
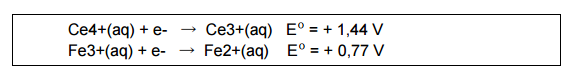
Nessas condições, é CORRETO afirmar que o potencial da reação global, quando se
atinge o ponto de equivalência, é
Uma amostra de K2SO4 comercial, contaminada com KCl, foi
submetida a um ensaio gravimétrico para a determinação de sua
pureza. Assim, 1,148g da amostra foi dissolvido em água e
tratada com solução de Ba(NO3)2 O precipitado, após os cuidados
necessários, foi pesado sendo observada a massa 1,398g.
O teor de K2SO4 na amostra é
Dados: Massas molares K24 = 174g.mol–1 KCl= 74,5g.mol–1
BaSO4 = 233g.mol–1
As informações a seguir referem-se às questões de nos 25 e 26. Soluções tampões são soluções que resistem a mudan- ças no pH, seja pela adição de um ácido ou de uma base. A fim de preparar uma solução tampão, um técnico utilizou solução aquosa de ácido acético a 0,1 mol/L que está 1% ionizada para posterior dissolução do sal de seu ânion.
A concentração dos íons acetato e o pH da solução ácida serão, respectivamente,

