O hipoclorito de sódio é um sal comumente presente na
formulação de produtos de limpeza.
A fórmula química do ânion desse sal é
Um objeto de massa igual a 50 g é atirado verticalmente
para cima partindo do solo e com velocidade inicial de
20 m/s. O objeto realiza um movimento com ausência de
forças dissipativas, atingindo uma altura máxima em rela-
ção ao solo e retornando, em seguida, ao local de lançamento.
A altura máxima, em metros, alcançada pelo objeto é igual a

Entre os elementos químicos encontrados no corpo humano, são classificados como não metais
No esquema seguinte, são apresentados, na escala de pH, a coloração e o intervalo de viragem para alguns indicadores disponíveis no laboratório.
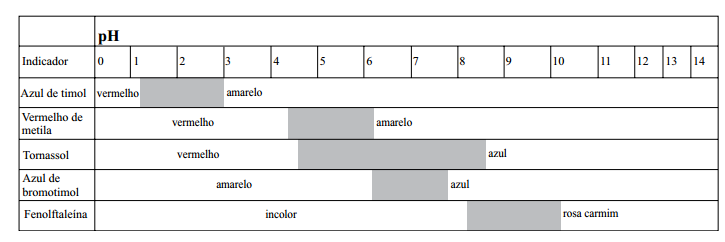
Considere que uma solução levemente ácida apresenta, a 25 ºC, variação de uma unidade de pH em relação à solução neutra
(pH 7,0).
Para confirmar a informação referente à baixa acidez da solução conforme descreve o item 3 do relatório, o indicador mais
adequado é
Em 1910, Ernest Rutherford e colaboradores executaram o famoso experimento com
partículas radioativas.
A respeito do experimento proposto por Rutherford é CORRETO afirmar que o que
conduziu seu experimento a propor um novo modelo atômico com núcleo pequeno e
denso foi o fato de que
O ozônio, embora benéfico na estratosfera, em que forma uma camada protetora contra
efeitos danosos da radiação ultravioleta, tem efeitos tóxicos nas camadas mais baixas da
atmosfera, por afetar diretamente os seres vivos. A molécula de ozônio consiste na sua
estrutura distâncias O–O iguais.
Sobre a molécula de ozônio e sua estrutura química, assinale com V as afirmativas
verdadeiras e com F as falsas.
( ) Para descrever adequadamente a estrutura do ozônio, escrevemos duas
estruturas de Lewis e indicamos que a molécula real é descrita pela média das
duas estruturas de ressonância.
( ) A estrutura de Lewis da molécula de ozônio é constituída por um ciclo que requer
ligações simples O–O de iguais energias de ligação.
( ) A estrutura de Lewis da molécula de ozônio consiste em moléculas lineares com
duas distâncias O–O iguais.
( ) A molécula de ozônio tem duas ligações O–O equivalentes, cujos comprimentos
são intermediários entre os comprimentos das ligações simples e dupla.
Assinale a alternativa que apresenta a sequência CORRETA.
O azobenzeno é um corante orgânico usado em muitas aplicações, como tingir tecidos.
Muitas tinturas azo são derivadas da substância orgânica C12H10N2. A fórmula estrutural
plana do azobenzeno está representada a seguir.
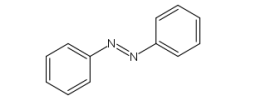
Sobre o azobenzeno, foram feitas as seguintes afirmativas:
I. A hibridizações nos átomos de nitrogênio são do tipo sp2.
II. O orbital 2p do nitrogênio exerce superposição frontal, produzindo uma ligação TT.
III. Cada átomo de carbono possui um orbital 2p não hibridizado.
A partir dessas observações, conclui–se que estão CORRETAS as afirmativas:
Um estudante de eletrônica foi preparar uma solução de cloreto férrico (FeCl3) para
corroer uma placa de circuito. Para isso, preparou 2 mol/L de solução de FeCl3 em um
balão volumétrico de 100 mL.
Considerando–se a solução de cloreto férrico preparada, qual a quantidade de mol de
cobre foi corroída se metade da quantidade de matéria de FeCl3 foi consumida no
processo de corrosão?
O fluoreto de lítio (LiF) é um sólido iônico que apresenta a estrutura cristalina igual à do
cloreto de sódio (NaCl). Veja a estrutura do NaCl abaixo:
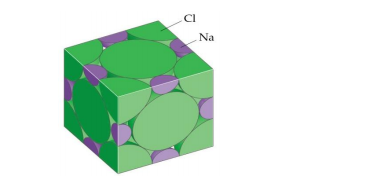
Considere que, hipoteticamente, os raios iônicos do Li+
e do F–são, respectivamente, 0,08 nm e 0,10 nm.
Sobre a estrutura cristalina do fluoreto de lítio, é CORRETO afirmar que
Considere que um químico recebeu uma solução para analisar se há a presença dos íons
Ag+, Ca2+ e/ou Hg2+. Os testes em sequência feitos pelo químico e os resultados obtidos
foram:
I. Adicionou à solução ácido clorídrico, e nada aconteceu.
II. Adicionou ácido sulfúrico diluído e formou–se um precipitado branco.
III. Filtrou o sólido e adicionou sulfeto de hidrogênio na solução residual e formou–se um
precipitado preto.
A partir das análises feitas pelo químico e seus resultados, é CORRETO afirmar que os
íons presentes na solução são
São espécies utilizadas como nucleófilos em uma reação de substituição nucleofílica,
EXCETO:
Considere as moléculas abaixo:
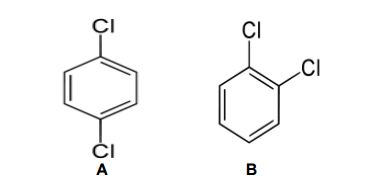
Analise as comparações realizadas entre as duas moléculas citadas.
I. A molécula B é o o–dicloro–benzeno e ela tem temperatura de ebulição mais baixa.
II. A molécula A é o p–dicloro–benzeno e ela tem polaridade mais baixa.
III. As moléculas A e B são isômeros de posição.
A partir dessa análise, conclui–se que estão CORRETAS.
Considere que um químico encontrou no almoxarifado algumas garrafas antigas de
reagentes. Um dos reagentes estava rotulado como óxido cobáltico mono–hidratado.
Assinale a alternativa que apresenta respectivamente a nomenclatura atual e a fórmula
química CORRETA.
Ao longo da história da ciência, as pessoas que fazem descobertas importantes são
frequentemente homenageadas, tendo os seus nomes ligados às descobertas. Embora
essa prática não seja muito comum atualmente, os métodos mais antigos tais como os
métodos argentimétricos, recebem o nome dos químicos responsáveis pelo seu
desenvolvimento.
Numere a COLUNA II de acordo com a COLUNA I, fazendo a relação entre o método
argentimétrico e o químico relacionado ao método.

Assinale a alternativa que apresenta a sequência CORRETA.
Considere que uma solução de um ácido fraco (Ka=10–10) com pH igual a 5 foi diluído 10
vezes.
Nessas condições, é CORRETO afirmar que a concentração da solução do ácido fraco
após sua diluição será igual a



