O esquema representa o processo de determinação do ponto de fusão de sólidos, tais
como o ácido benzoico. As dez etapas, em sequência lógica, que melhor expressam a
montagem do sistema para a determinação do ponto de fusão do ácido benzoico são:
10ª. Repetir o procedimento algumas vezes para comprovar o resultado.
Sabendo que o hidróxido de alumínio é o composto gelatinoso que aglutina impurezas presentes na água, ao tentar diminuir seu efeito, reage-se 1 mol do composto com 1 mol de ácido sulfúrico. Assinale a alternativa que corresponde CORRETAMENTE ao produto salino originado.
Uma análise química consiste na determinação dos componentes de uma amostra. Quando o objetivo é isolar e identificar os compostos químicos (elementos, íons, moléculas...), denomina-se análise qualitativa. Assinale a alternativa INCORRETA.
A técnica de precipitação é amplamente utilizada na química analítica. Os métodos gravimétricos são quantitativos e se baseiam em medidas de massa. Sobre a gravimetria, todas as alternativas estão corretas, EXCETO:
O laboratório de química é um ambiente no qual estamos sujeitos a muitos
riscos químicos, biológicos, e de acidentes com a manipulação de aparelhos. Para
manter um ambiente seguro para todos é necessário estar atentos a algumas regras
de segurança. Sobra a segurança no laboratório, assinale as alternativas
VERDADEIRAS.
I. EPI são equipamentos de proteção individual e podem ser definidos como dispositivos
ou produtos de uso individual pelo trabalhador destinados à proteção de riscos à
saúde e segurança.
II. Medidas de proteção coletivas, como a utilização de capelas de exaustão, podem ser
descartadas, desde que o analista esteja utilizando seu equipamento de proteção
individual.
III. Empregados que não utilizam os EPI’s necessários, embora o empregador tenha
fornecido, podem sofrer sanções trabalhistas.
IV. EPI’s em mal estado de conservação e higienização podem se tornar fonte de
contaminação.
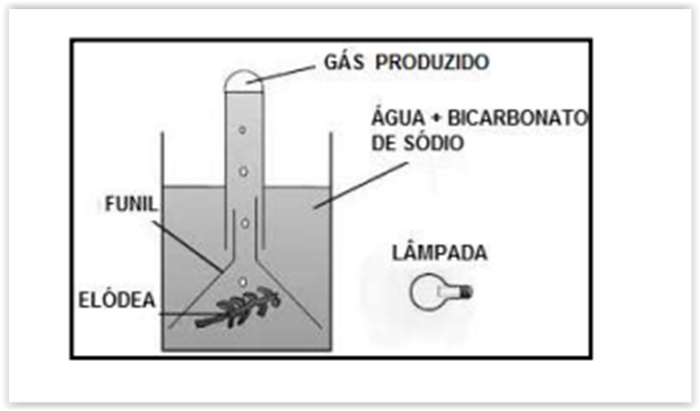
Durante uma aula de Ciências foi montado o
seguinte experimento: dois béqueres foram
preenchidos com uma solução de bicarbonato de
sódio e neles foram colocados funis de vidro
contendo ramos de Elódea (planta aquática). Nos
dois funis, um tubo de ensaio foi emborcado
contendo água e algumas gotas de solução de
fenolftaleína e hidróxido de sódio até a boca (a
fenolftaleína adquire coloração rosada em meio
básico e incolor, em meio ácido). Estas montagens
foram feitas impedindo a entrada de ar nos tubos e
a formação de bolhas.
Um conjunto foi colocado em presença de luz e
outro foi mantido no escuro. Passado algum tempo,
comparou-se a quantidade de gás produzido pelas
plantas em ambos os conjuntos e a coloração da
solução de fenolftaleína. Também se verificou o tipo
de gás produzido, retirando-se os tubos de ensaio
dos sistemas (sem deixar escapar o gás no interior
dos mesmos, tampando-os com o dedo) e
introduzindo em cada um deles, uma piaçava em
brasa.
Sobre o experimento realizado, espera-se que:
Observe a equação da reação química a seguir, onde A, B e
C são valores de coeficientes da equação:
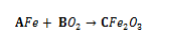
Caso seja feito o balanceamento da equação, os valores
corretos dos coeficientes A, B e C serão:
No laboratório, principalmente de Química, o acondicionamento de soluções ácidas e básicas deve ser uma prática adequada e correta, para evitar alteração na composição e outros danos. Das alternativas a seguir, indique a forma CORRETA de acondicionamento de solução de ácido sulfúrico e de solução de ácido fluorídrico, respectivamente:
Relacione o tipo de resíduo químico (coluna à esquerda)
com o respectivo exemplo (coluna à esquerda):
Tipo de Resíduos
Químicos
I. Básicos
II. Metais preciosos ou recicláveis
III. Oxidantes fortes
IV. Redutores fortes (exceto metais e ligas)
V. Solventes descartáveis
VI. Solventes recicláveis
Exemplo
( ) Soluções ou sais de dicromato, permanganato, hipoclorito, iodato, persulfato, bismuto (III). Solução de bromo, iodo, peróxido de idrogênio. Sólidos: bismutato de sódio, dióxido de chumbo e ácido crômico.
( ) Cabeça e cauda de destilação, solvente de limpeza, solventes contaminados de difícil purificação e misturas azeotrópicas.
( ) Hidrazina, soluções ou sais de sulfito, iodeto, tiossulfato, oxalato, ferro (II), estanho (II) e fósforo vermelho.
( ) Aminas, soluções de hidróxidos, soda cáustica, solução alcoolato e amônia.
( ) Solventes de HPLC, extração Sohxlet e rotaevaporados, e formol.
( ) Sais ou soluções contendo prata, ósmio, ouro, platina e rutênio.
Assinale a alternativa com a sequência CORRETA
de cima para baixo:
As variações de entalpia que ocorrem durante as reações químicas com frequência têm o mesmo interesse prático que as relações de massas, pois, no caso das reações de combustão, que envolvem combustíveis como o gás natural e petróleo, são realizadas cotidianamente mais pela energia térmica que liberam do que pelos seus produtos da combustão. Por exemplo, a combustão de 1,00 mol de metano, CH4, produz dióxido de carbono e água e libera 802 kJ mol–1 . Quando 3,00 mol de oxigênio reagem com uma quantidade estequiométrica de metano, qual é ?H para a reação?
Devido à grande emissão de gases lançados na
atmosfera, nas regiões mais populosas é evidente a
ocorrência da chuva ácida. Na sua precipitação, um
dos ácidos responsáveis pela acidez é o sulfúrico.
Um equilíbrio envolvido na formação desse ácido na
água da chuva está representado pela equação:
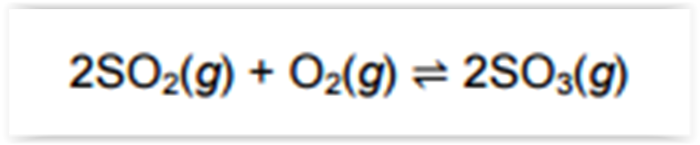
Considere que são colocados 6 mol de SO2, 5 mol
de O 2 e 4 mol de SO3 num recipiente fechado de 5,0 L
para reagirem até o sistema atingir o equilíbrio a dada
temperatura. A variação do número de mol dos gases
participantes está registrada no gráfico.
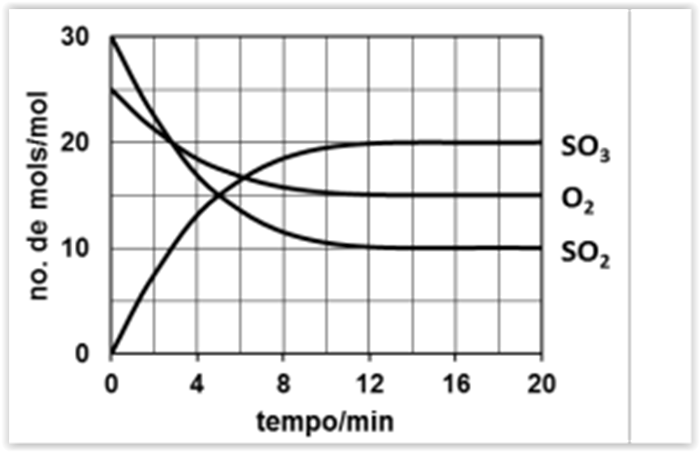
Nestas condições, a constante de equilíbrio, KC, é igual a:
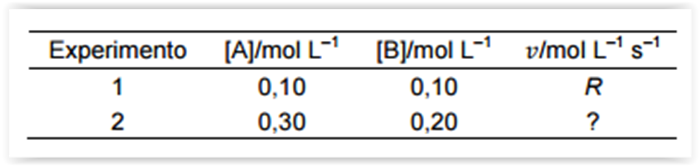
Existem muitos motivos para estudar a velocidade
de uma reação, do ponto de vista prático, o
conhecimento das velocidades de reações é útil na
concepção de medicamentos, no controle da
poluição e no processamento de alimentos, bem
como nas aplicações de setores produtivos em
geral. Então para exemplificar, considere que a
velocidade de uma reação entre os compostos A e
B segue a lei de velocidade,
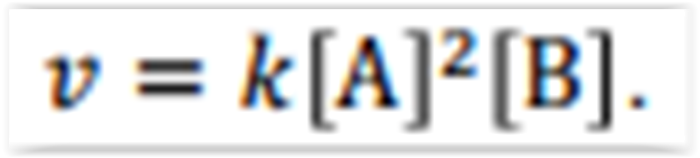
velocidade do Experimento 2 observada a mesma
temperatura do Experimento 1.
Qual o número de moléculas de glicose que existem
em 200 mL de uma solução aquosa que, em seu
preparo, se tenha dissolvido 18 g desse açúcar em
água, completando-se o volume final com esse
solvente para 2 L? Dado: 1 Da= 1,66 x10-24 g.
Assinale a alternativa CORRETA:
A Lei Federal nº 12.490/2011 regula e autoriza as várias atividades relacionadas a, entre outros, um biocombustí- vel líquido derivado de biomassa renovável. O principal componente desse biocombustível é o álcool etílico, que pode ser utilizado, diretamente ou mediante alterações, em motores a combustão interna com ignição por centelha, em outras formas de geração de energia ou em indústria petroquímica. Podendo ser obtido por rotas tecnológicas distintas, conforme especificado em regulamento, o biocombustível de que a Lei trata é o
Um litro de solução de fluoreto de amônio a 1000 ppm possui quantos g/L do soluto?