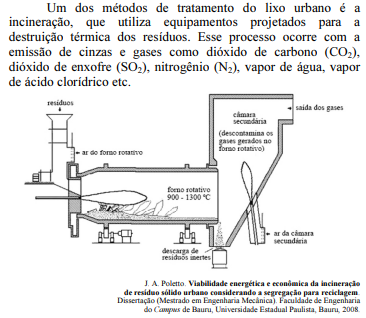
Considerando as informações e a ilustração apresentadas, julgue o próximo item.
Ao atingir a atmosfera, o SO2, em contato com a água, forma o ácido sulfuroso, que provoca a chuva ácida.
A nitroglicerina é uma molécula altamente instável que explode se aquecida ou submetida a fortes impactos. Nesse processo são produzidas nuvens de gases, que se expandem rapidamente, além de intenso calor. A reação química (não balanceada) para esse fenômeno é descrita a seguir.
C3H5N3O9 (l) N2 (g) + CO2 (g) + H2O (g) + O2 (g)
A soma dos menores inteiros que balanceiam corretamente essa equação é igual a
O gás carbônico (CO2) é o principal produto proveniente da queima completa de compostos orgânicos. O aumento da concentração desse gás na atmosfera tem provocado uma série de desequilíbrios ambientais, além de afetar a saúde humana.
Levando em consideração a estrutura dessa molécula, avalie se as afirmativas a seguir estão corretas.
I. Possui geometria molecular do tipo linear.
II. É formada por ligações covalentes entre carbono e oxigênio.
III. É classificada como uma molécula polar.
Está correto o que se afirma em
(Números atômicos: C = 6; O = 8)
Caso 50 mL de uma solução de Mg(OH)2 0,1 mol/L sejam misturados com 50 mL de Mg(OH)2 0,25 mol/L, então, o volume de HCl 5 mol/L necessário para neutralizar completamente 30 mL dessa nova solução básica será
A tabela periódica atual é organizada em linhas verticais (famílias) e linhas horizontais (períodos). Os elementos que estão organizados na mesma família possuem características comuns, como é o caso principalmente
Observe a cadeia carbônica a seguir e classifique-a respectivamente quanto à disposição dos átomos, quanto aos tipos de ligações, quanto à presença de heteroátomos e quanto à presença de ramificação:
H3C– C(CH3)2–CH2– C–O–CH2–CH3
A vanilina é um composto orgânico extraído da semente de baunilha e que é bastante utilizado como agente aromatizante em bebidas e alimentos. Sua fórmula estrutural está representada a seguir:
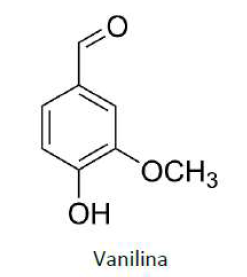
As funções orgânicas presentes em sua estrutura são
Considere a tabela de temperaturas de fusão (TF) e temperaturas de ebulição (TE) de algumas
substâncias hipotéticas, todas sujeitas às mesmas condições de pressão.
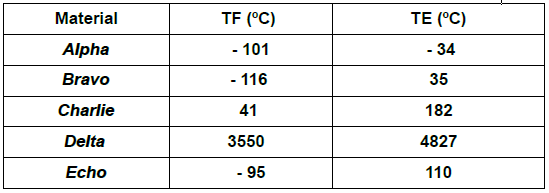
Acerca desta tabela e de seus dados, são feitas as seguintes afirmativas:
I – À temperatura de 25 ºC, o material Alpha está no estado sólido.
II – À temperatura de 50 ºC, os materiais Bravo e Delta estão no estado líquido.
III – À temperatura de 30 ºC, os materiais Charlie e Echo estão no estado gasoso.
IV – À temperatura de 145 ºC, os materiais Alpha, Bravo e Echo estão no estado gasoso.
V – À temperatura de 1450 ºC, o material Delta está no estado sólido.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:

Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto. Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1.
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas
Considere a equação da reação hipotética: X + Y + Z → W + T + Q São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
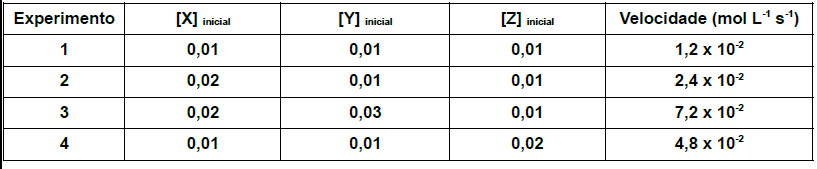
Considere [ ] = concentração mol L-1.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
Reação química causou explosão em paiol no RJ
A explosão no arsenal da Marinha na ilha do Boqueirão (RJ) foi provocada pela combustão espontânea de amostras de pólvora, armazenadas no paiol de trânsito – aquele usado para guardar a munição retirada dos navios. (...) Para entrar em combustão espontânea, a pólvora teve contato com umidade. A umidade provocou reações químicas na pólvora, que pegou fogo e provocou um incêndio. (...) Segundo a Folha apurou, esse é o resultado do laudo que explicará as causas do acidente, ocorrido em 16 de julho passado (...).
https://www1.folha.uol.com.br/fsp/1995/8/25/cotidiano/27.html Acesso em 22/06/2020.
Uma reação que pode ocorrer com a pólvora é
2 KNO3 + S + 3 C → K2S + N2 + 3 CO2
Em uma reação completa, foram obtidos 135 kg de produtos, a partir da queima de 101 kg de nitrato de potássio e 16 kg de enxofre. A quantidade de carvão queimada, em quilogramas, foi de
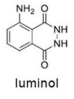
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023 átomos de hidrogênio.
Existem diversas técnicas para a coleta de impressões digitais em cenas de crimes que estão relacionadas com a composição do suor. O suor, simplificadamente, é uma solução aquosa de eletrólitos. O Na+ é um dos eletrólitos encontrados no suor pela dissolução de sais, por exemplo, o cloreto de sódio, cuja entalpia de dissolução em água é igual a −3,8 kJ/mol. O sódio é do grupo 1, ou família 1A, e está no terceiro período da Tabela Periódica. Acerca desse assunto, julgue os itens a seguir.
A temperatura da água aumenta com a dissolução de NaCl.
Os cátions Li+, Mg2+ e Al3+ e os ânions F−, Br− e O2− podem formar compostos binários entre si. Entre esses compostos, os que apresentam ligação com maior caráter iônico e maior caráter covalente são, respectivamente,
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Finalizado o processo, restou unicamente carbonato de sódio no cadinho, verificando-se uma perda total de massa de 6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a quantidade de CO2 seco desprendido do cadinho seja igual a 2,20 g, assinale a opção que indica a quantidade, em gramas, de Na2CO3 • 10 H2O existente na mistura inicial.

