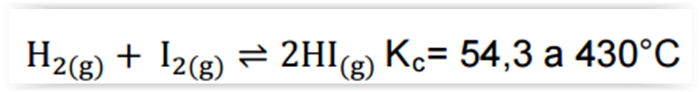Considerando-se a reação de formação a seguir, assinalar a alternativa CORRETA:
Com base nos conceitos de equilíbrio químico, julgue os itens
subsequentes.
O equilíbrio químico ocorre quando há um equilíbrio dinâmico entre reagentes e produtos em uma reação química, ou seja, a condição na qual os processos direto e inverso ocorrem simultaneamente em velocidades iguais.
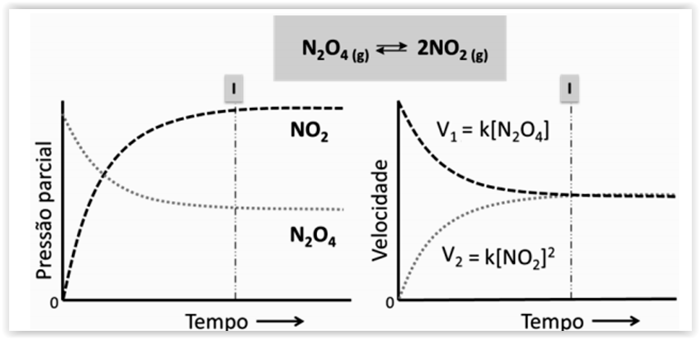
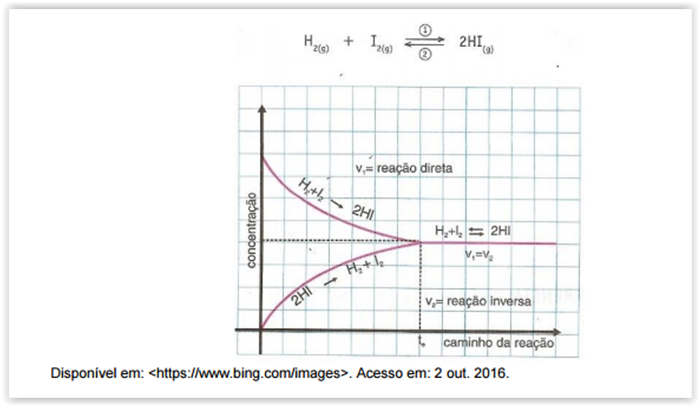
Considerando-se a figura a seguir, assinalar a alternativa CORRETA:
Com base nos conceitos de equilíbrio químico, julgue os itens
subsequentes.
Pelo princípio de Le Chatelier, quando uma força é aplicada a um sistema em equilíbrio dinâmico, o equilíbrio tende a se ajustar para minimizar o efeito da força. Um exemplo disso seria o fato de que uma reação no equilíbrio tende a seguir em uma reação endotérmica quando se aumenta a temperatura.
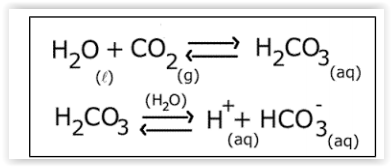
As reações a seguir representam o sistema de
tamponamento sanguíneo do bicarbonato
O aumento no pH sanguíneo resulta
“Quando alguma condição que determina o equilíbrio é
modificada, o sistema responde, no sentido de amenizar a
perturbação sofrida”.
O texto corresponde ao(à):
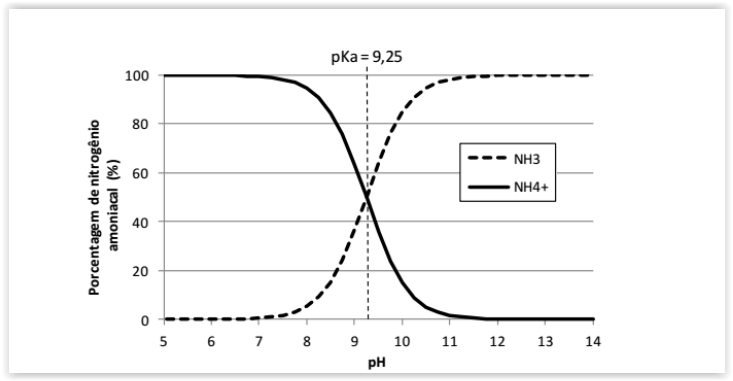
A amônia é um gás incolor à temperatura ambiente e possui um odor
extremamente forte. Seu caráter polar é a principal razão para a sua solubilidade em
água, sendo que em ambientes aquáticos, o nitrogênio amoniacal compreende as
formas do íon amônio (NH4+) e da amônia (NH3) dissolvidos, de maneira que a
proporção entre elas depende da temperatura, salinidade e, principalmente, do pH
do meio.
De acordo com o gráfico acima e os conhecimentos sobre equilíbrio químico.
Assinale a alternativa CORRETA:
Considere o gráfico a seguir
Por meio da análise do gráfico, é possível destacar que o equilíbrio
Quando PbCl2 sólido é adicionado à água pura à 25°C, o sal dissolve até a concentração de Pb2+ se igualar a 1,57 x 10-2 mol L-1. Após essa concentração, o sólido em excesso permanece insolúvel. Qual o Kps desse sal?
Um analista recebeu uma solução de NaOH 0,5 mol/L (NaOH – MM = 40 g/mol) para ser padronizada. Nesta padronização, foi usado, adequadamente como padrão primário, o ácido oxálico dihidratado (H2C2O4 . 2H2O – MM = 126,07 g/mol) convenientemente preparado. O analista mediu uma massa equivalente a 0,8303 g de ácido oxálico dihidratado e a diluiu em 100 mL de água em um Erlenmeyer, adicionando algumas gotas de fenolftaleína. O analista encheu uma bureta de 50 mL com a solução de NaOH e iniciou a titulação dos 100 mL da solução de ácido oxálico. O ponto de viragem, em que a fenolftaleína tornou‐se violeta, foi alcançado quando o volume NaOH da bureta era de 27,3 mL e a titulação parou. Assinale a alternativa que apresenta o valor da concentração padrão de NaOH.
A produção de hidrogênio para uso industrial, que tem como um
dos principais mercados a produção de amônia, intermediário de
fertilizantes, é bem conhecida e feita por processo de reforma de
gás natural, rico em metano, representado pelo equilíbrio:
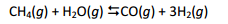
Em um balão fechado sob temperatura constante essa reação
tem uma constante de equilíbrio (Kc) igual a 4,00
A análise desse sistema gasoso em equilíbrio determinou a
concentração de metano = 0,100 mol.L–1, de água = 0,005 mol.L–1
e de monóxido de carbono = 0,250 mol.L–1
Nessas condições, a concentração de gás hidrogênio nesse
equilíbrio, em mol.L–1, é de
Os óxidos de nitrogênio são os componentes principais das
névoas, um fenômeno ao qual os habitantes das grandes cidades
estão habituados. O óxido nítrico forma‐se em pequenas
quantidades nos cilindros de combustão interna dos motores
pela combinação direta de nitrogênio e oxigênio:
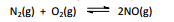
A constante de equilíbrio para essa reação aumenta de
aproximadamente 10–15 a 300K para cerca de 0,05 a 2400 K
(temperatura aproximada no cilindro de um motor em
funcionamento).
Com relação à reação entre o gás nitrogênio e o gás oxigênio,
assinale a afirmativa correta.
Em um recipiente de volume constante foi efetuada a reação de
decomposição:
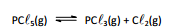
Inicialmente a pressão parcial do pentacloreto de fósforo era de
2,0 bar. A atingir o equilíbrio foi constatada uma porcentagem de
decomposição de 98%.
Se esse sistema em equilíbrio for perturbado pela adição de
0,01 mol de gás cloro, mantendo-se constante as condições
anteriores, quando o novo equilíbrio for atingido
A sílica gel utilizada nos dessecadores apresenta coloração azul na forma anidra e rosa na presença de umidade. Este fenômeno pode ser representado na equação a seguir.
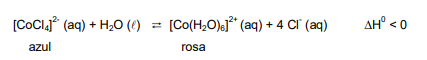
A cor azul pode ser observada quando o sistema em equilíbrio é:
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
A eventual dissolução de nitrato de amônio em água causaria a diminuição do pH da água.