
No que diz respeito às construções linguísticas do texto 11A3CCC, julgue o item subsequente.
Na linha 19, a contração “pelas" poderia ser substituída por com as, mantendo-se a correção gramatical e o sentido do texto.

Considerando o texto precedente e as competências e habilidades a serem desenvolvidas em língua portuguesa conforme os Parâmetros Curriculares Nacionais do Ensino Médio (PCNEM), julgue o item a seguir.
Para que o estudante seja capaz de considerar a língua portuguesa como fonte de legitimação de acordos e condutas sociais, cabe, em sala de aula, o trabalho com textos, devendo o professor propor práticas de leitura, de produção escrita e de análise linguística, embora possa ser dispensada a verbalização.

Considerando o texto precedente e as competências e habilidades a serem desenvolvidas em língua portuguesa conforme os Parâmetros Curriculares Nacionais do Ensino Médio (PCNEM), julgue o item a seguir.
O ensino da língua portuguesa na sala de aula busca perpetuar a variedade padrão da língua portuguesa, independentemente do seu exercício na vida social, e permitir que o aluno seja capaz de empregá-la em situação formal de fala ou escrita.
No que se refere a competências e habilidades a serem desenvolvidas em língua portuguesa conforme os PCNEM, julgue o próximo item.
De acordo com os PCNEM, o estudo da gramática deve servir como estratégia para a compreensão, interpretação e produção de textos, e a literatura deve integrar-se à área de leitura.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Na alquimia, a transformação da matéria era discutida a partir de concepções filosóficas permeadas de misticismo.

Considere as reações I, II e III a seguir.
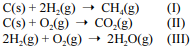
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023 moléculas de H2(g) para a formação de 32,0 g de metano.

Considere as reações I, II e III a seguir.
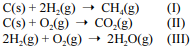
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação I, e que m2 gramas de O2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação II. Conforme a lei de Richter, são necessários 2 × m1 gramas de H2(g) para reagir completamente com m2 gramas de O2(g), de acordo com a reação III.
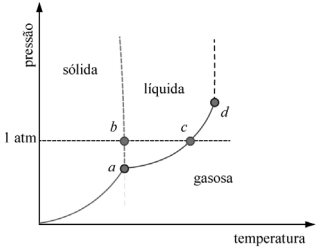
A figura precedente mostra um diagrama de fase para uma substância pura que exibe três fases: sólida, líquida e gasosa. Com base nessas informações, julgue o item subsecutivo.
No ponto a da figura do diagrama de fase, as fases gasosa, líquida e sólida coexistem.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A massa de H2S presente em 250 mL de uma solução aquosa com concentração 0,100 mol/L do ácido é superior a 1,0 g.
Considere que, para determinar a concentração de uma solução de H
2S, um químico tenha misturado uma alíquota de 20,0 mL dessa solução com 20,0 mL de uma solução-padrão de NaOH (aq) 0,430 mol/L. Após a reação de neutralização, ele determinou o excesso de NaOH na solução resultante por meio da titulação dessa solução com 20,0 mL de uma solução-padrão de HC
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita, tiverem sido gastos 16,0 mL da solução que contenha o excesso de NaOH, então infere-se que a concentração da solução de H2S é igual a 9,00 × 10-2 mol/L.
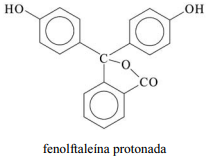
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
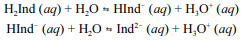
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A fórmula molecular da fenolftaleína protonada é C20H16O4.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
De acordo com a tabela periódica atual, os elementos de um mesmo período, por apresentarem o mesmo número de elétrons de valência, formam compostos químicos com características semelhantes.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O produto principal da reação de hidratação do propeno em meio ácido é o 1-propanol.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
De acordo com a teoria das colisões, um aumento na temperatura de reação ocasiona aumento no número total de colisões entre as espécies reagentes e na fração de colisões efetivas.
Com relação aos materiais utilizados nos laboratórios de ensino de química e às normas de segurança laboratoriais, julgue o item subsequente.
As luvas de látex são adequadas e resistentes para manusear ácidos, bases e quaisquer solventes orgânicos.

