Analise as afirmativas a seguir sobre termoquímica.
I. Em uma reação endotérmica, a entalpia do sistema reativo cresce, ou seja, a entalpia dos produtos é maior do que a entalpia dos reagentes.
II. A lei da conservação de energia estabelece que a energia não é criada nem destruída em uma mudança de estado físico.
III. A variação de entalpia da reação depende do caminho que as reações ocorrem – Lei de Hess.
Está(Estão) correta(s) a(s) afirmativa(s)
Suponha que 10 g de iodo-131 são produzidos para uma determinada aplicação radioterápica, e que essa aplicação permanece eficaz até uma massa mínima de 0,625 g. Considerando seu tempo de meia-vida igual a oito dias, por quanto tempo, em dias, todo esse iodo produzido pode ser empregado nessa aplicação?
O texto a seguir foi adaptado de Quim. Nova, v. 39, 732-
740, 2016
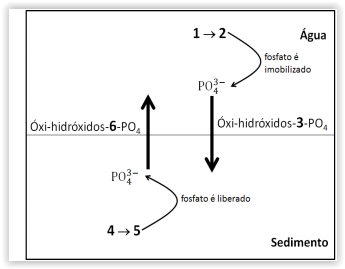
“Nos ambientes aquáticos, a concentração de fosfatos na
coluna de água é dependente de alguns fatores, como o par
redox Fe(II)/Fe(III), uma vez que nas camadas superficiais
sua associação com os oxi-hidróxidos de Fe(III) formam
compostos que apresentam baixa solubilidade e migram
para camadas mais profundas (sedimento). Nessas camadas
os oxi-hidróxidos de Fe(II), mais solúveis que os
compostos de Fe(III, são formados, com a liberação do
fosfato, estabelecendo um ciclo onde o fósforo migra
novamente para as camadas superficiais."
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
O tempo necessário para a formação de 709 g de Cl2, a partir
da eletrólise da solução aquosa de NaCL, é superior a 2 h.
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
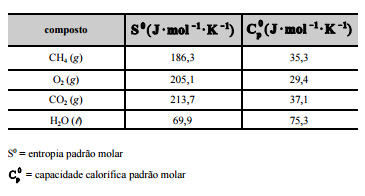
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Se o consumo mensal de energia elétrica da referida empresa
for de 1,0 × 1012 J, a combustão do CH4 (g), sob pressão
constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
CO2 para suprir as necessidades mensais de energia da
empresa.
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
Na eletrólise da solução aquosa de NaCR, a formação do Cl2
ocorre no ânodo da célula.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Na proteção com metal de sacrifício, o material a ser protegido
é conectado como ânodo de uma célula galvânica, sendo o
cátodo um metal mais ativo que se consome à medida que
protege o material.
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.

Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Há casos benéficos de corrosão, como a oxidação de aços
inoxidáveis, que produz uma camada protetora de óxido de
cromo, e a proteção do material de alumínio, com a formação
de óxido de alumínio.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Considerando os potenciais de oxidação mostrados a seguir, é
correto afirmar que a limpeza de aço inoxidável com cloro
pode ser recomendada por impedir a corrosão devido ao menor
potencial de oxidação (E) do ferro (Fe) em relação ao cloro
(Cl).
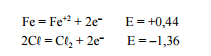
Os compostos binários, cujo elemento mais eletronegativo é o oxigênio, classificam‐se em: óxidos, peróxidos e superóxidos, em função do valor no número de oxidação (Nox) do átomo de oxigênio. Assinale a alternativa que apresenta somente peróxidos. (Considere apenas o conceito, independente de sua estabilidade ou não.)