As substâncias húmicas presentes nos solos, nos sedimentos e
nas águas naturais são formas importantes de distribuição da
matéria orgânica na Terra.
O controle das propriedades físicas e químicas dos vários
ambientes naturais está relacionado à presença dessas
substâncias.
Assinale a opção que apresenta propriedades das substâncias
húmicas.
No laboratório de Ciências o professor colocou 3 mL de água oxigenada (H2O2) em um tubo de ensaio, acrescentou uma pitada de um catalisador (MnO2 ) e, imediatamente, ocorreu uma efervescência, característica da liberação de um gás. Para testar o gás liberado, o professor introduziu um barbante em brasa dentro do tubo e a brasa inflamou. A repetição do experimento com água pura, em vez de água oxigenada, não teve o mesmo resultado, isto é, a brasa ficou mais fraca e não se inflamou. O experimento permitiu que os alunos concluíssem que o gás liberado era
O conceito de solubilidade pode ser trabalhado em sala de aula
por meio de análise da curva de solubilidade apresentada sob a
forma de gráficos e/ou da realização de experimentos simples
que mostrem os fatores que alteram a solubilidade.
Após uma discussão sobre esse assunto em sala de aula foram
levantados pelos alunos alguns fatores que alteram a solubilidade
tais como: o solvente, o ponto de fusão do soluto, a temperatura
da solução, a pressão, as interações intermoleculares envolvidas.
O fator apresentado pelos alunos que deve ser rediscutido por
não influenciar na solubilidade das substâncias é
A companhia distribuidora adiciona um produto ao gás denominado odorante. A função do odorante é
Para que os alunos verificassem a composição química de alguns
alimentos, o professor distribuiu seis diferentes tipos de
alimentos numerados, pedindo que os submetessem aos
seguintes testes:
I.esfregassem cada um deles sobre um papel absorvente; e
II.Pingassem uma gota de iodo diluído sobre cada um.
Os resultados desses testes foram registrados, de comum acordo
com a turma, no quadro.
A tabela a seguir mostra os resultados obtidos.
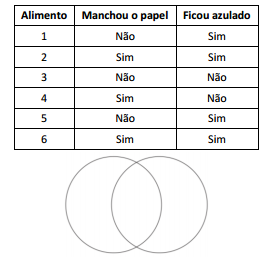
Em seguida, o professor pediu que os alunos escrevessem o
número dos alimentos que contivessem apenas gordura no
círculo da esquerda e, os que contivessem apenas amido, no
círculo da direita.
Na intercessão dos dois círculos deveriam ser colocados os
alimentos que contivessem gordura e amido. Para indicá-los, os
alunos deveriam escrever
Para demonstrar como as correntes de ar se formam, o professor de Ciências colocou um bastão de incenso aceso próximo à porta da sala, que estava ligeiramente aberta, e pediu aos alunos que, ao observarem o movimento da fumaça, constatassem que o ar entrava por baixo da porta e saía por cima. O experimento permitiu que os alunos concluíssem que o ar frio
O triângulo apresentado a seguir representa objetos de interesse
da Química, colocando no centro os materiais e substâncias e, em
cada um dos vértices, aspectos diferentes do conhecimento
químico com eles relacionados.
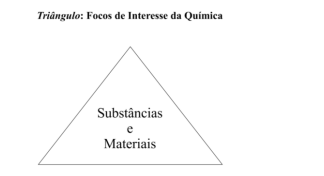
Segundo a proposta de MACHADO, (2014, p. 157) os vértices
desse triângulo devem corresponder aos seguintes aspectos:
Considere a figura a seguir.
De acordo com a figura, assinale a alternativa que apresenta a associação correta das
substâncias ao seu respectivo símbolo de segurança:
Um resíduo pode ser classificado a partir das características de
seus constituintes. Os resíduos perigosos são classificados
considerando suas características de inflamabilidade,
corrosividade, reatividade e patogenicidade e recebem,
respectivamente os códigos D001, D002, D003 e D004
Os componentes presentes em grande quantidade em quatro
resíduos distintos, estão listados na tabela a seguir
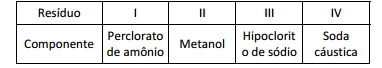
Os códigos relacionados a estes resíduos são:
Sobre as ligações químicas, analise as afirmativas.
I. Nas estruturas de Lewis, a ligação covalente resulta do compartilhamento de um par de elétrons entre dois átomos. Esse compartilhamento é uma característica particular das ligações encontradas na maioria das moléculas orgânicas.
II. Com o desenvolvimento da mecânica quântica, Linus Pauling introduziu o conceito de ressonância para explicar o tipo de situação, em que duas possíveis estruturas de Lewis coexistiriam sob a forma de estruturas ressonantes. Por exemplo, a representação das ligações no O3 é uma média de duas estruturas ressoantes possíveis.
III. Quando ocorre a ligação química pela transferência de elétrons de um átomo (que fica positivo) para outro átomo (que fica negativo), a ligação formada denomina‐se ligação iônica.
Está(ão) correta(s) a(s) afirmativas
Sobre as ligações químicas, assinale a afirmativa INCORRETA.
Os compostos binários, cujo elemento mais eletronegativo é o oxigênio, classificam‐se em: óxidos, peróxidos e superóxidos, em função do valor no número de oxidação (Nox) do átomo de oxigênio. Assinale a alternativa que apresenta somente peróxidos. (Considere apenas o conceito, independente de sua estabilidade ou não.)
Considere que os compostos com NaCl, LiBr, K2SO4, entre outros, são iônicos e formados a partir de íons (cátions e ânions) que se juntam para formar essas substâncias. São características (ou propriedades) típicas atribuídas aos compostos iônicos, EXCETO:
Óxidos são compostos em que o elemento mais eletronegativo é o oxigênio com número de oxidação total e igual a – 2 (Nox = – 2). De acordo com o comportamento dos óxidos frente a outras substâncias, eles podem ser classificados em: ácidos, básicos ou anfotéricos. Assinale a alternativa que apresenta um óxido ácido.
Sobre as ligações químicas, analise as afirmativas.
I. A característica principal das ligações iônicas é a grande diferença de eletronegatividade entre os átomos. Um átomo deve ter baixa energia de ionização e o outro uma elevada afinidade eletrônica.
II. A atração eletrostática entre os íons na ligação iônica é a força mais significativa da estabilização da ligação.
III. A baixa energia de ionização necessária para uma ligação iônica é característica dos metais. A alta energia de afinidade eletrônica, que também é necessária para uma ligação iônica, é uma característica dos elementos químicos não metálicos, que necessitam de um, dois ou três elétrons para completar suas camadas de valência.
Está(ão) correta(s) a(s) afirmativa(s)


